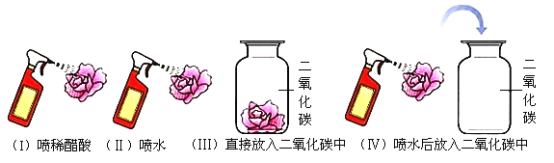
题目内容
【题目】盐酸硫酸和硝酸是三种常用的酸,为什么初中化学只介绍了盐酸和硫酸,没有介绍硝酸呢?兴趣小组同学在实验室发现一瓶硝酸,发现硝酸保存在棕色试剂瓶中,小组的同学对此产生了好奇,并对硝酸的部分性质进行如下探究。
[查阅资料]①棕色试剂瓶常用于保存见光易分解的物质;②NO是无色气体,能与空气中的氧气迅速反应生成NO2,NO2是红棕色气体,低温时转化成液体N2O4;③相同条件下,气体的体积比等于气体分子数目之比;④无水氯化钙可干燥NO、NO2、H2、O2等。
[提出问题]硝酸具有哪些化学性质?
[提出猜想]猜想一:硝酸不稳定,易分解;
猜想二:稀硝酸可与铁反应产生氢气;
猜想三:硝酸能与氢氧化钠反应。
[实验探究]
实验操作 | 实验现象 | 实验结论 | |
① | 取少量浓硝酸于试管中,用酒精灯加热 | 产生红棕色气体 | 猜想一正确 |
② | 向稀硝酸中加入少量铁粉 | 有气泡产生,气体在试管口由无色变为红棕色,铁粉逐渐溶解,得到黄色溶液 | 猜想二不正确 |
③ | 向稀硝酸中滴加氢氧化钠溶液 | 无明显现象 | 猜想三不正确 |
[交流讨论](1)小明认为铁与稀硝酸反应产生的气体是NO,他的依据是___________________。
(2)小江认为实验③的结论不严谨,他重新设计方案验证猜想三,请补充小江的实验报告:
实验操作 | 实验现象 | 实验结论 |
_______________。 | _______________。 | 猜想三正确 |
[继续探究]为验证硝酸分解的气体产物,在老师的指导下,小组同学设计如图装置:
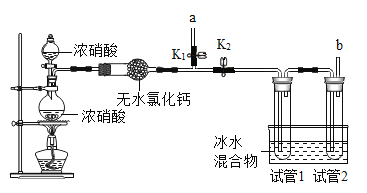
[实验步骤] I.关闭K2,打开K,加热观察到有红棕色气体产生,当有红棕色气体由导管口a逸出时,将带火星的木条放在导管口a处,观察到木条复燃;
II.打开K2,关闭K1,一段时间后,试管1中出现无色液体,试管2中无明显现象,将带火星的木条放在导管口b处,观察到木条复燃。经进一步实验确认浓硝酸分解的产物有三种,则浓硝酸分解产生的气体为____________。
[知识拓展]小江分析上述实验后,认为二氧化氮具有助燃性,请说明理由_____________。
【答案】参加反应的物质中含有氮元素和氧元素,NO是无色气体,能与空气中氧气反应生成红棕色的NO2 先向氢氧化钠溶液中滴加几滴无色酚酞试液,再逐滴加人稀硝酸(合理即可) 滴加无色酚酞试液后显红色,加人稀硝酸后颜色变浅,最后变成无色(与上空对应) NO2、O2 由硝酸分解的产物可知硝酸分解的化学方程式,其中二氧化氮与氧气的分子数目之比为4:1,即分解的气体产物中二氧化氮与氧气的体积比为4:1,二者的混合气体能使带火星的木条复燃,对比带火星的木条在空气中的现象可知二氧化氮具有助燃性(合理即可)。
【解析】
[交流讨论]
(1)铁和稀硝酸为反应物,从质量守恒定律中的元素守恒分析,可知反应生成的气体可能是一氧化氮;从现象分析,铁与稀硝酸反应产生的气体开始无颜色,上升至试管口时变成红棕色,根据[查阅资料],可知一氧化氮是无色气体,一氧化氮可与空气中的氧气迅速反应生成二氧化氮,二氧化氮是红棕色气体,所以铁与稀硝酸反应生成的气体是一氧化氮;
(2)氢氧化钠与硝酸反应生成硝酸钠和水,硝酸钠易溶于水,所以反应无明显现象,要证明反应确实发生了,可利用酸碱指示剂,先向氢氧化钠溶液中滴加几滴无色酚酞试液,再逐滴加人稀硝酸,观察到溶液先变红色,随着稀硝酸的加入,溶液颜色逐渐变浅,最后变成无色,证明反应后的溶液中没有氢氧化钠,即氢氧化钠与稀硝酸发生了反应;
[实验步骤]
根据试管1中有无色液体产生,结合二氧化氮的性质可知,浓硝酸分解生成了二氧化氮,根据带火星的木条放在导管口b处可以复燃,说明浓硝酸分解的产物中有氧气,再结合浓硝酸的分解产物有三种,根据质量守恒定律可知,另一种产物是水,即浓硝酸分解生成的气体为二氧化氮、氧气;
[知识拓展]
氧气能使带火星的木条复燃,氧气约占空气体积的五分之一,空气不能使带火星的木条复燃,根据浓硝酸分解的化学方程式![]() 可知,浓硝酸分解产生的气体中氧气占气体总体积的五分之一,根据实验现象,浓硝酸分解产生的混合气体可使带火星的木条复燃,由此可知二氧化氮具有一定的助燃性。
可知,浓硝酸分解产生的气体中氧气占气体总体积的五分之一,根据实验现象,浓硝酸分解产生的混合气体可使带火星的木条复燃,由此可知二氧化氮具有一定的助燃性。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】阅读下面科普短文。
“菠菜豆腐”是我国的传统菜肴,近年来,有关“菠菜豆腐”的争论主要集中在钙吸收率方面。菠菜中富含易溶于水的草酸,若单独吃菠菜,其中的草酸会结合胃内食糜中的部分铁和锌,还能够进入血液,沉淀血液中所含的钙。而将豆腐与菠菜同食,豆腐中的可溶性钙与菠菜中的草酸结合成不溶性的草酸钙(CaC2O4)沉淀,既能够保护食物中的铁和锌等元素,还能保证人体内的钙不被草酸结合。因此,豆腐与菠菜同食仍不失为一个好的搭配。
研究人员以新鲜菠菜和新鲜豆腐为材料,进行了“菠菜豆腐”烹调方法的研究。
(实验1)探究菠菜质量对菜肴中可溶性钙含量的影响。实验结果如下:
豆腐/ g | 10 | 10 | 10 | 10 | 10 |
菠菜/ g | 5 | 10 | 15 | 20 | 25 |
可溶性钙/总钙 | 0.364 | 0.287 | 0.186 | 0.125 | 0.088 |
(实验2)探究菠菜焯水时间对菜肴中可溶性钙含量的影响。
用100g豆腐和250g菠菜(焯水时间不同)制成菜肴,测定每100g“菠菜豆腐”中可溶性钙的质量,结果见下图。

以上研究表明,烹调“菠菜豆腐”时,如能适当减少菠菜的比例,并预先将菠菜焯水,则豆腐中钙的吸收率将会显著提高。
根据文章内容,回答下列问题:
(1)可溶性钙中的“钙”是指_________(“钙单质”或“钙元素”)。
(2)豆腐中富含的营养素是_____________。
A. 维生素 B. 糖类 C. 蛋白质 D. 油脂
(3)结合实验1的数据分析,可得到的结论是_________________。
(4)用焯水后的菠菜制作“菠菜豆腐”,能提高可溶性钙含量的原因是__________。
(5)草酸钙在高温下完全分解可得到两种气态氧化物和一种固态氧化物,该反应的化学方程式为____________________。