题目内容
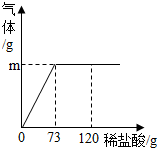 为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示:
为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示:(1)反应中产生气体的质量为
(2)求样品中碳酸钠的质量分数是多少?
(3)当加入120g稀盐酸时,烧杯中溶质的化学式
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)烧杯中的物质前后减少的质量为二氧化碳的质量.
(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数.
(3)当加入120g稀盐酸时,盐酸过量分析解答.
(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数.
(3)当加入120g稀盐酸时,盐酸过量分析解答.
解答:解:(1)二氧化碳的质量=12g+73g-80.6g=4.4g;故填:4.4g;
(2)设样品中Na2CO3的质量为x.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
=
解得:x=10.6g
纯碱样品中Na2CO3的质量分数为:
×100%=88.3%
答:纯碱样品中Na2CO3的质量分数为88.3%.
(3)由图示可知,当加入120g稀盐酸时,盐酸过量,故烧杯中的溶质是氯化钠和氯化氢;答案:NaCl和HCl.
(2)设样品中Na2CO3的质量为x.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
解得:x=10.6g
纯碱样品中Na2CO3的质量分数为:
| 10.6g |
| 12g |
答:纯碱样品中Na2CO3的质量分数为88.3%.
(3)由图示可知,当加入120g稀盐酸时,盐酸过量,故烧杯中的溶质是氯化钠和氯化氢;答案:NaCl和HCl.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列现象不能用质量守恒定律来解释的是( )
| A、蜡烛燃烧后长度越来越短,最后消失 |
| B、高锰酸钾受热后固体质最减少 |
| C、铁丝在氧气中燃烧,固体质量增加 |
| D、潮湿的衣服在阳光下晒干 |
如图为某化学反应的微观示意图,其中“●”和“○”表示不同元素的原子,下列说法错误的是( )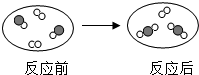

| A、化学反应前后原子个数不变 |
| B、生成物是氧化物 |
| C、生成物的每个分子由三个原子构成 |
D、参加反应的 和 和 的个数比为2:1 的个数比为2:1 |
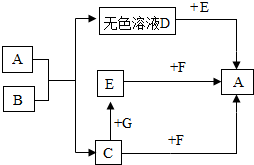 图中的A、B、C、D、E、F、G都是初中化学中的常见物质.其中A是一种盐,常用作建筑材料,B是人体胃液中所含的一种酸,C是植物光合作用的一种原料,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,F、G是碱.它们之间存在以下转化关系(图中部分生成物已略去).
图中的A、B、C、D、E、F、G都是初中化学中的常见物质.其中A是一种盐,常用作建筑材料,B是人体胃液中所含的一种酸,C是植物光合作用的一种原料,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,F、G是碱.它们之间存在以下转化关系(图中部分生成物已略去).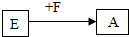 的化学反应方程式:
的化学反应方程式:
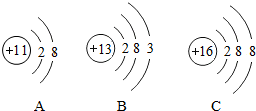 图为三种微粒的结构示意图.
图为三种微粒的结构示意图.