题目内容
取铝、铜的混合粉末,在空气中充分灼烧后,加入稀硫酸到固体恰好溶解,再加入一定量的铁粉,充分反应后过滤,得到金属固体和滤液.
(1)滤液中溶质一定有 ,滤出的固体中一定含有 .
(2)设计简单的实验方案,探究滤出的固体成分 (写出实验步骤、现象和结论).
.
(1)滤液中溶质一定有
(2)设计简单的实验方案,探究滤出的固体成分 (写出实验步骤、现象和结论).
考点:金属的化学性质
专题:金属与金属材料
分析:在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则不能与酸反应;位置靠前的金属一般可以将位于其后的金属从它们的盐溶液中置换出来,根据金属与酸反应的情况,来判断和探究反应后滤渣的成分.
解答:解:(1)取铜、铝混合粉末,在空气中充分灼烧后,生成对应的金属氧化物,再加入稀硫酸至固体恰好溶解后,生成对应的硫酸盐,即:硫酸铜溶液和硫酸铝溶液;“再加入一定量的铁粉”时,我们根据“在金属活动性顺序中,位置靠前的金属一般可以将位于其后的金属从它们的盐溶液中置换出来”,可以得知铁能把铜置换出来,而不能把铝置换出来,所以滤渣中一定含有铜;根据铁与硫酸铜溶液反应的化学方程式可以知道反应后生成硫酸亚铁和铜,所以滤液中一定有反应后生成的硫酸亚铁和未参加反应的硫酸铝溶液,所以滤液中溶质一定有硫酸铝、硫酸亚铁,滤出的固体中一定含有铜;
(2)根据“在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则不能与酸反应”,我们可以利用向滤渣中加入稀盐酸的办法,通过反应是否有气泡生成来判断滤渣中是否含有铁,所以鉴别的步骤是:取滤渣少量于试管中,向滤渣中加盐酸若有气泡,滤渣为铜和铁,若滤渣中加盐酸无气泡,滤渣为铜.
故答案为:(1)硫酸铝、硫酸亚铁,铜;
(2)取滤渣少量于试管中,向滤渣中加盐酸若有气泡,滤渣为铜和铁,若滤渣中加盐酸无气泡,滤渣为铜.
(2)根据“在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则不能与酸反应”,我们可以利用向滤渣中加入稀盐酸的办法,通过反应是否有气泡生成来判断滤渣中是否含有铁,所以鉴别的步骤是:取滤渣少量于试管中,向滤渣中加盐酸若有气泡,滤渣为铜和铁,若滤渣中加盐酸无气泡,滤渣为铜.
故答案为:(1)硫酸铝、硫酸亚铁,铜;
(2)取滤渣少量于试管中,向滤渣中加盐酸若有气泡,滤渣为铜和铁,若滤渣中加盐酸无气泡,滤渣为铜.
点评:本题从置换反应能否发生的角度考查了金属活动性顺序及其应用,是一道综合性较强的好题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列使用酒精灯的实验操作中正确的是( )
| A、使用前将酒精灯内的酒精装满 |
| B、用酒精灯的外焰给物质加热 |
| C、向燃着的酒精灯内添加酒精 |
| D、使用后用嘴吹灭酒精灯 |
下列各组溶液中不用其他试剂,仅用组内的物质相互反应就能鉴别的是( )
| A、NaOH FeCl3 MgCl2 |
| B、Na2SO4 BaCl2 Na2CO3 |
| C、KNO3 CuSO4 NaCl |
| D、NaNO3 BaCl2 KCl |
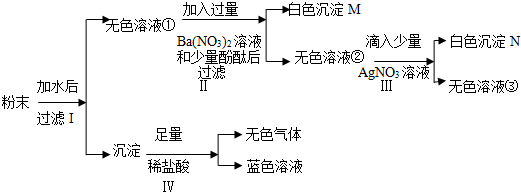
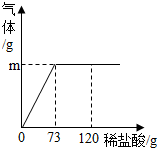 为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示:
为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示: