题目内容
硫酸工业的部分生产流程如下:
SO2
SO3→H2SO4
某硫酸生产厂以黄铁矿(主要成分为FeS2)为原料生产硫酸,首先将矿石粉吹入沸腾炉里燃烧,制得SO2,其反应可表示为:□FeS2+□O2=□Fe2O3+□SO2.
(1)配平矿石粉在沸腾炉中燃烧的反应方程式.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
SO2→SO3: ; SO3+ →H2SO4: .
(3)SO2→SO3的反应过程中,V2O5的作用是: .
(4)沸腾炉的炉渣主要成分为Fe2O3,可变废为宝用于炼铁.写出高炉炼铁主要反应的化学方程式: .
(5)市售硫酸多为98%的浓硫酸,实验室常将浓硫酸稀释成稀硫酸使用.稀释操作时,必须将 ,否则会造成危险.
SO2
| O2 |
| V2O5 |
某硫酸生产厂以黄铁矿(主要成分为FeS2)为原料生产硫酸,首先将矿石粉吹入沸腾炉里燃烧,制得SO2,其反应可表示为:□FeS2+□O2=□Fe2O3+□SO2.
(1)配平矿石粉在沸腾炉中燃烧的反应方程式.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
SO2→SO3:
(3)SO2→SO3的反应过程中,V2O5的作用是:
(4)沸腾炉的炉渣主要成分为Fe2O3,可变废为宝用于炼铁.写出高炉炼铁主要反应的化学方程式:
(5)市售硫酸多为98%的浓硫酸,实验室常将浓硫酸稀释成稀硫酸使用.稀释操作时,必须将
考点:物质的相互转化和制备,浓硫酸的性质及浓硫酸的稀释,铁的冶炼,化学方程式的配平,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据反应前后原子种类和原子个数不变分析;
(2)根据化合反应的特点结合元素守恒分析;
(3)根据反应条件及反应的方程式分析作用;
(4)根据高炉炼铁的原理写出反应的方程式;
(5)根据浓硫酸的稀释方法分析.
(2)根据化合反应的特点结合元素守恒分析;
(3)根据反应条件及反应的方程式分析作用;
(4)根据高炉炼铁的原理写出反应的方程式;
(5)根据浓硫酸的稀释方法分析.
解答:解:(1)根据化学反应前后原子种类、原子个数不变,结合化学方程式的配平(奇数配偶法)可知:在氧化铁化学式的前面加2,使氧原子的个数变成偶数,因此铁原子的个数是4,再二硫化亚铁的化学式前加4,硫原子的个数是8,因此在二氧化硫化学式的前面加8,再结合氧原子的个数,在氧气化学式的前面加11,故化学方程式为:4FeS2+11O2=2Fe2O3+8SO2;
(2)以SO2为原料生产硫酸,其过程中的反应均为化合反应,因此SO2→SO3是二氧化硫和氧气的反应生成三氧化硫;SO3→H2SO4是三氧化硫和水反应生成硫酸,故反应的方程式为:2SO2+O2
3SO3;SO3+H2O═H2SO4;
(3)SO2→SO3的反应过程中,V2O5是作为反应条件,因此是催化剂,起到催化作用;故答案为:催化作用;
(4)高炉炼铁是一氧化碳与氧化铁反应生成铁和二氧化碳,故反应的方程式为:3CO+Fe2O3
2Fe+3CO2;
(5)稀释浓硫酸时,必须把浓硫酸缓慢倒入水中,并不断搅拌,否则容易产生危险;故答案为:浓硫酸缓慢倒入水中,并不断搅拌.
(2)以SO2为原料生产硫酸,其过程中的反应均为化合反应,因此SO2→SO3是二氧化硫和氧气的反应生成三氧化硫;SO3→H2SO4是三氧化硫和水反应生成硫酸,故反应的方程式为:2SO2+O2
| ||
| △ |
(3)SO2→SO3的反应过程中,V2O5是作为反应条件,因此是催化剂,起到催化作用;故答案为:催化作用;
(4)高炉炼铁是一氧化碳与氧化铁反应生成铁和二氧化碳,故反应的方程式为:3CO+Fe2O3
| ||
(5)稀释浓硫酸时,必须把浓硫酸缓慢倒入水中,并不断搅拌,否则容易产生危险;故答案为:浓硫酸缓慢倒入水中,并不断搅拌.
点评:本题综合考查了质量守恒定律、方程式的书写、浓硫酸的稀释以及实验方案的设计,考查了学生的基础知识的熟练程度以及知识的灵活运用能力.

练习册系列答案
相关题目
化学方程式2A+B═C+2D中,A的相对分子质量为50,B的相对分子质量为74,若C的相对分子质量为100,则D的相对分子质量为( )
| A、24 | B、37 | C、74 | D、124 |
下列物质的用途与其依据的性质不相符合的是( )
| A、一氧化碳用于冶金工业--一氧化碳能够燃烧 |
| B、金刚石用于裁玻璃--金刚石很硬 |
| C、干冰用于人工降雨--干冰易升华同时吸收大量的热 |
| D、石墨用于制铅笔芯--石墨很软 |
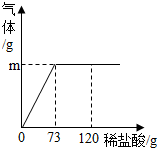 为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示:
为测定某纯碱样品中碳酸钠的质量分数(含有少量的杂质氯化钠),现称取碳酸钠样品12g,放在烧杯中,加入稀盐酸,当稀盐酸滴入至73g时,烧杯内溶液的总质量为80.6g,假设产生的气体全部溢出,生气体的质量与加入稀盐酸的质量如图所示: