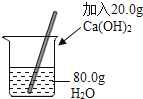
题目内容
【题目】为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中.多次实验后,取平均值所得数据如表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |
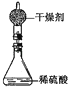
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 .
(2)该合金中锌的质量分数.
【答案】
(1)0.4g
(2)
【解析】解:(1)反应生成氢气的质量为:342.10g+16.00g﹣357.70g=0.4g,
故填:0.4g.
2)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.4g ![]()
x=13g,
该合金中锌的质量分数为: ![]()
答:该合金中锌的质量分数为81.25%.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下面的表格中列出了氯化铵在不同温度下的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
(1)从表中可得到的一条信息是;
(2)20℃时,向100g水中加入50g氯化铵,形成氯化铵的(填“饱和”或“不饱和”)溶液,将其温度升高至60℃时,所得溶液的质量为;
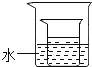
(3)将(2)中所得的60℃时的氯化铵溶液放入如图所示的小烧杯中,在大烧杯的水中加入下列物质,能够使小烧杯中有固体析出的是 (填字母序号);
A.冰
B.氯化钠
C.硝酸铵
D.氧化钙
(4)某同学欲配制20℃时20%的氯化铵溶液500g,需要氯化铵的质量 . 他在量取水时俯视读数,在其他操作都无误的情况下,他配制的溶液的溶质质量分数将(填“偏大”或“偏小”).