题目内容
【题目】(14分)实验室有几瓶未知浓度的氢氧化钠溶液,某兴趣小组同学欲用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想和做法:
(1)(7分)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
①酚酞溶液的作用是 ;
②氢氧化钠与盐酸反应的化学方程式为 ;
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,试求甲组这瓶氢氧化钠溶液中溶质的质量分数和反应后所得溶液中溶质的质量分数(写出计算过程,结果用百分数表示)。
(2)(5分)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母)。
A.将pH试纸剪成几段节约使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸用蒸馏水润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
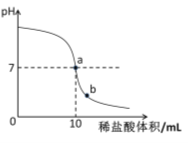
请回答:图中a点表示的含义是 ;b点溶液中的溶质有 (填化学式);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 。
(3)(2分)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。请用化学方程式表示其变质的原因 ;
【答案】(1)①判断反应是否恰好完成(或判断是否完全反应等)
②NaOH+HCl=NaCl+H2O ③1.6% 0.95%
(2)①AC ②恰好中和 NaCl、HCl 稀盐酸的密度
(3)CO2 + 2NaOH = Na2CO3 + H2O
【解析】
试题分析:(1) ①由于氢氧化钠溶液和稀盐酸反应没有明显的现象,故酚酞溶液的作用是:判断反应是否恰好完成(或判断是否完全反应等)
②氢氧化钠与盐酸反应的化学方程式为:NaOH+HCl=NaCl+H2O
③根据化学方程式NaOH+HCl=NaCl+H2O中HCl 与NaOH、NaCl 的质量关系,可求出NaOH、NaCl 的质量,进一步计算氢氧化钠溶液中溶质的质量分数和反应后所得溶液中溶质的质量分数
解:设NaOH的质量为x,NaCl的质量为y
NaOH + HCl = NaCl + H2O
40 36.5 58.5
x 7.3g×1% y
40:36.5=x:7.3g×1% x=0.08g
所以氢氧化钠溶液中溶质的质量分数=0.08g/5g×100%=1.6%
36.5:58.5=7.3g×1%:y y=0.117g
而溶液的质量=5g+7.3g=12.3g
所以反应后所得溶液中溶质的质量分数=0.117g/12.3g×100%=0.95%
(2)①使用pH试纸的方法正确的是:将pH试纸剪成几段节约使用,将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上,而不能将pH试纸直接插入待测液中,也不能将pH试纸用蒸馏水润湿后放在玻璃片上,故选A、C
②从图中可以看出,a点溶液的PH=7,故a点表示的含义是氢氧化钠溶液和稀盐酸恰好中和;从图中可以看出,b点溶液的PH<7,说明酸过量,故b点溶液中的溶质除了反应生成的NaCl,还有过量的HCl;乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外(稀盐酸的溶质质量分数,以及消耗稀盐酸的体积),你认为还需要的数据是:稀盐酸的密度
(3)氢氧化钠溶液已经部分变质是跟空气中的二氧化碳发生反应,化学方程式为:CO2 + 2NaOH = Na2CO3 + H2O

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案【题目】(9分)张华同学对酸、碱、盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | ZnCl2 | FeCl2 |
思考:根据以上盐中的金属元素的排列,可以得出他是依据______________顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学式或离子符号:

(3)张华同学发现酸、碱、盐之间的反应都有盐类物质生成。请写出一个能生成MgCl2的复分解反应的化学方程式:__________________________。
(4)我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢?
猜想与假设:盐溶液的pH可能为:pH=7、pH<7、pH>7.
设计与实验:下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验:甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.
记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液 | CuSO4溶液 | K2CO3溶液 | |
甲同学 | 7 | 4 | 10 |
乙同学 | 7 | 5 | 9 |
结论:通过测定几种盐溶液的pH,可以得出的结论是: .
评价与反思:上述两同学测得的数据,反映了溶液真实pH的是 同学。