题目内容
碳和氧化铜的混合物18.2g,隔绝空气加强热充分反应后,剩余物质的质量为13.8g,经测定其中有氧化铜剩余.
(1)氧化铜中铜的质量分数为 ;
(2)通过计算确定原混合物中氧化铜的质量分数?(计算结果保留到0.1%)
(1)氧化铜中铜的质量分数为
(2)通过计算确定原混合物中氧化铜的质量分数?(计算结果保留到0.1%)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据化合物中元素的质量分数=
×100%进行解答;
(2)隔绝空气加强热,碳和氧化铜充分反应生成二氧化碳气体和铜;生成的气体二氧化碳放出而使反应后物质质量减小,反应前后质量差即为完全反应生成二氧化碳的质量;氧化铜有剩余,则可推断碳已经完全反应,利用二氧化碳的质量求出碳的质量,进而求出氧化铜的质量即可.
| 相对原子质量×原子个数 |
| 相对分子质量 |
(2)隔绝空气加强热,碳和氧化铜充分反应生成二氧化碳气体和铜;生成的气体二氧化碳放出而使反应后物质质量减小,反应前后质量差即为完全反应生成二氧化碳的质量;氧化铜有剩余,则可推断碳已经完全反应,利用二氧化碳的质量求出碳的质量,进而求出氧化铜的质量即可.
解答:解:(1)氧化铜(CuO)里铜元素的质量分数为
×100%=80%;故填:80%;
(2)充分反应生成二氧化碳的质量=18.2g-13.8g=4.4g.
设反应掉的碳的质量为x
2CuO+C
2Cu+CO2
12 44
x 4.4g
=
x=1.2g
原混合物中氧化铜的质量分数=
×100%=93.4%
答:原混合物中氧化铜的质量分数为93.4%.
| 64 |
| 64+16 |
(2)充分反应生成二氧化碳的质量=18.2g-13.8g=4.4g.
设反应掉的碳的质量为x
2CuO+C
| ||
12 44
x 4.4g
| 12 |
| x |
| 44 |
| 4.4g |
x=1.2g
原混合物中氧化铜的质量分数=
| 18.2g-1.2g |
| 18.2g |
答:原混合物中氧化铜的质量分数为93.4%.
点评:本题难度不大,根据质量守恒定律判断出固体减少的质量是生成二氧化碳的质量是解答本题的突破口.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
“低碳经济”以低能耗、低排放、低污染为基础,其实质是提高能源利用效率和创建清洁能源结构,保护环境.下列说法中,不符合这一理念的是( )
| A、大力发展火力发电符合“低碳经济”理念 |
| B、杜绝“长明灯”、“长流水”现象,节约每一度电,每一滴水 |
| C、研制和开发新能源替代传统能源是实现低碳排放的有效措施 |
| D、平时家里不用的废纸片、塑料袋、易拉罐都做成了精美的手工艺品 |
下列做法不会危害人体健康的是( )
| A、用工业明胶制老酸奶 |
| B、用“干冰”冷藏食物 |
| C、用甲醛溶液浸泡海产品 |
| D、用霉变的花生压榨花生油 |
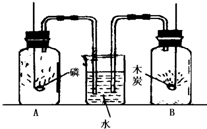 使适量的磷和木炭在等容积的A、B两瓶中同时燃烧.如图所示.试回答:
使适量的磷和木炭在等容积的A、B两瓶中同时燃烧.如图所示.试回答: