题目内容
已知锌和稀硫酸(H2SO4)反应生成硫酸锌和氢气,现在有10克锌样品与足量的稀硫酸反应生成0.22升氢气,求锌样品的纯度.(温馨提示:在计算过程保留一位小数,氢气的密度为0.09克/升)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:利用密度与气体的体积即可求出氢气的质量,根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出锌的质量.
解答:解:生成氢气的质量为:0.22升×0.09克/升=0.02克
设样品中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.02g
=
x=0.65g
锌样品的纯度为:
×100%=6.5%
答案:锌样品的纯度为6.5%
设样品中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.02g
| 65 |
| 2 |
| x |
| 0.02g |
x=0.65g
锌样品的纯度为:
| 0.65g |
| 10g |
答案:锌样品的纯度为6.5%
点评:此题是根据化学方程式的计算题,我们计算的依据是化学方程式,所以务必要保证我们的出发点即化学方程式要书写正确,然后再根据相对分子质量的比进行求算.

练习册系列答案
相关题目
下列是有关古语和相应理化知识本质的解释,其中错误的是( )
| A、“山顶有泉,煮米不成饭”--山顶气压较低,泉水的沸点较高,水不容易沸腾 |
| B、“曾青得铁则化为铜”---湿法炼铜的原理 |
| C、“司南之杓,投之于地,其抵指南”--地球周同存在磁场 |
| D、“人要实,火要虚”--可燃物与氧气的接触面积越大,燃烧越剧烈 |
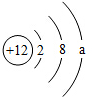 ,该粒子的核电荷数为
,该粒子的核电荷数为