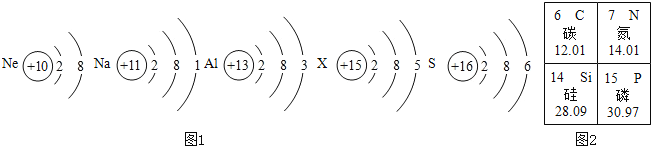题目内容
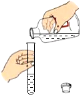
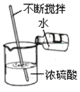
【题目】有一包黑色固体粉末,可能含有CuO、Fe、C粉末中的几种,将固体粉末放在烧杯中,做如图实验(CuO+H2SO4=CuSO4+H2O):

(1)向固体B中加入稀硫酸,看到有气泡冒出,则滤液A中的溶质是_____。
(2)固体D的质量和固体E的质量相等,则固体粉末的成分是_____,说明推断的理由_____。
(3)如果要全部回收铜,在上面实验的基础上,还应如何操作?(写出具体的操作步骤)_____。
【答案】硫酸亚铁 CuO、Fe、C 铜和氧气加热生成氧化铜,碳和氧气点燃生成二氧化碳,铜增加的质量等于减少的碳的质量 在固体E中加入足量的稀硫酸溶解氧化铜,然后用铁丝将铜置换出来。
【解析】
氧化铜和稀硫酸反应生成硫酸铜和水,铁和稀硫酸反应生成硫酸亚铁和氢气,铁和硫酸铜反应生成硫酸亚铁和铜,碳不会与稀硫酸反应,所以
(1)向固体B中加入稀硫酸,看到有气泡冒出,说明固体B中含有铁,说明样品中铁是足量的,滤液A中的溶质是硫酸亚铁,故填硫酸亚铁;
(2)由题意可知铜和氧气加热生成氧化铜,碳和氧气点燃生成二氧化碳,铜增加的质量等于减少的碳的质量,固体粉末的成分是CuO、Fe、C,故填CuO、Fe、C;
(3)在固体E中加入足量的稀硫酸溶解氧化铜,然后用铁丝和硫酸铜反应将铜置换出来,故填在固体E中加入足量的稀硫酸溶解氧化铜,然后用铁丝将铜置换出来。

【题目】已知硝酸钾在不同温度下的溶解度如表:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度(g/100g 水) | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
甲是 80℃含有 100g 水的 KNO3 溶液,操作过程如图所示。以下分析错误的是( )
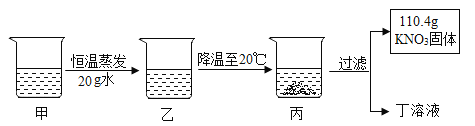
A. 甲一定是不饱和溶液,乙可能饱和溶液
B. 甲乙丙丁溶液中溶质的质量分数关系式乙>甲>丙=丁
C. 甲溶液中,溶剂与溶质的质量比为 25:34
D. 甲溶液冷却时,开始析出固体的温度在 60℃~70℃之间
【题目】含碳元素的物质在自然界中普遍存在.请回答下列问题:
(1)已知碳元素的原子结构示意图为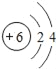 ,其最外层电子数为_____.
,其最外层电子数为_____.
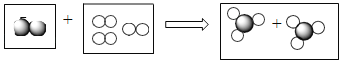
(2)请根据下图提供的信息,在相应的位置上写出不同单质的名称或化学式:
名称:_____ | 化学式:_____ | 名称:_____ |
可用于制铅笔芯 |
分子结构 |
单质图片 |
(3)近几十年来,大气中CO2的含量不断上升,使全球变暖.导致大气中CO2含量不断上升的主要因素是(填写序号)_____.
①人和动物的呼吸 ②植物的光合作用 ③化石燃料的大量使用和森林遭到破坏.