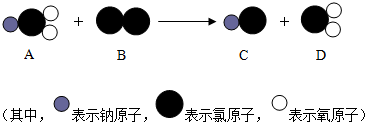
题目内容
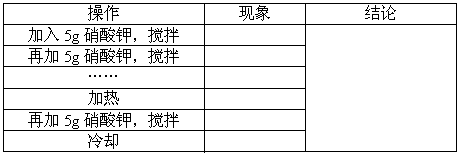
用硝酸钾代替氯化钠进行上述实验,每次加入
5g.加了几次后才使烧杯中硝酸钾固体有剩余而不再继续溶解?然后加热烧杯,观察剩余固体有什么变化.再加入5g硝酸钾,搅拌,观察现象.待溶液冷却后,又有什么现象发生?
答案:略
解析:
解析:
|
用硝酸钾代替氯化钠进行上述实验.不过,当有硝酸钾剩余时,改用加热的方法,而不是继续加入溶剂的方法:
|

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目