题目内容
现有铁和氧化铁的混合物10.0 g,用一氧化碳充分还原后得到铁
7.6 g,试计算10.0 g混合物中氧化铁的质量分数。
7.6 g,试计算10.0 g混合物中氧化铁的质量分数。
80%
设原混合物中含铁的质量为x。
Fe2O3+3CO=2Fe+3CO2
160 112
10.0 g-x 7.6 g-x
160∶112="(10.0" g-x)∶(7.6 g-x),
解得:x="2.0" g
混合物中含氧化铁的质量分数为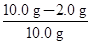 ×100%=80%。
×100%=80%。
Fe2O3+3CO=2Fe+3CO2
160 112
10.0 g-x 7.6 g-x
160∶112="(10.0" g-x)∶(7.6 g-x),
解得:x="2.0" g
混合物中含氧化铁的质量分数为
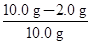 ×100%=80%。
×100%=80%。
练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目