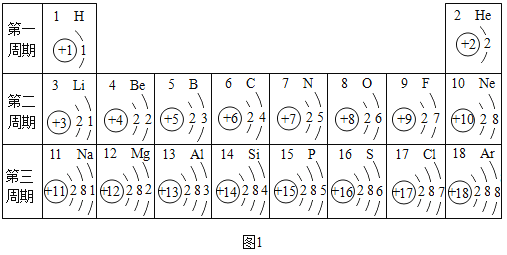
题目内容
【题目】人类文明进步与金属材料发展关系十分密切。
(1)下图所示金属制品的主要用途,利用金属导电性的是_________(填序号)。

(2)港珠澳大桥是我国自行设计建造的又项世界级工程。中科院的科研人员为港珠澳大桥钢管桩提供了世界顶级的高性能防腐涂层,其防腐涂层是环氧树脂粉末为核心的涂料体系,主要用于重腐蚀条件,其防锈的原理是______________。请写出一种生活中防止钢铁制品生锈的方法的____________。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点,这是利用了铝合金的___________等优点(写出两条)。生活中的铝制品在空气中具有优良的抗腐蚀性能,原因是_____________(用化学方程式表示)。
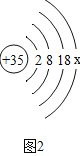
(4)某合金中含有金属钪(Sc)。相同条件下,取相同状态的金属钪和锌分别与相同质量分数的盐酸反应,钪产生气泡速率明显更快,则Sc与Zn的金属活动性顺序是____________。已知Sc与稀盐酸发生置换反应,生成+3价化合物,写出该反应的化学方程式___________。
【答案】B 隔绝空气和水 涂油、刷漆 密度小、硬度大、抗腐蚀性能强 4Al+3O2=2Al2O3 钪>锌 2Sc+6HCl=2ScCl3+3H2↑
【解析】
(1)金属做导线利用了金属的导电性,故选B。
(2)环氧树脂粉末可以隔绝空气和水,起到防止生锈的作用。生活中防止钢铁生锈的方法有涂油、刷漆等。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点,这是利用了铝合金的密度小、硬度大、抗腐蚀性能强的特点。生活中的铝制品在空气中具有优良的抗腐蚀性能,原因是铝易与空气中的氧气反应生成致密的氧化铝保护膜,反应的方程式为:4Al+3O2=2Al2O3。
(4)相同状态的金属钪和锌分别与相同质量分数的盐酸反应,钪产生气泡速率明显更快,说明钪比锌活泼。Sc与稀盐酸发生置换反应,生成+3价化合物,该反应的化学方程式为:2Sc+6HCl=2ScCl3+3H2↑。

【题目】一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。某小组为探究其成分进行如下实验:
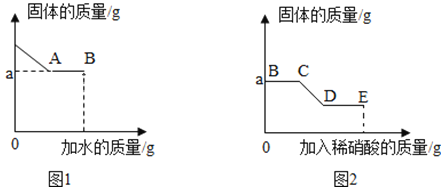
I.取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图I所示:
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红。
Ⅲ.向实验I所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
(1)CD段可观察到的现象是__________,从D到E的溶液的pH________(填“增加”“减小”“不变”)
(2)根据上述实验得出原固体中一定有______________。
(3)为进一步探究该白色固体成分,进行如下实验:
步骤 | 现象 | 结论 |
取实验Ⅱ反应后的溶液于试管中,加入________ | ______ | 原固体中有氢氧化钠 |
取实验Ⅱ反应后的溶液于试管中,加入过量硝酸酸化,再加入硝酸银 | _________ | 原固体中无氯化钾 |