题目内容
实验室制取O2有以下方法:
2H2O2 2H2O+O2↑ 2KMnO4?K2MnO4+MnO2+O2↑
2H2O+O2↑ 2KMnO4?K2MnO4+MnO2+O2↑
(1)某化学兴趣小组进行制取O2的有关实验.取3.2g 纯净的KMnO4加热到220℃,测得生成O2的质量为0.36g,明显超过理论产量.为探究多余O2的来源,请提出合理的假设,并设计实验方案证明你的假设.
假设________.
实验方案________.
(2)甲同学发现,将H2O2与KMnO4混合后,在酸性条件下也有O2放出.据此他认为,H2O2也可以在KMnO4和酸的催化作用下发生分解反应.乙同学为验证甲的观点,重做了实验.他将含H2O21.7g的双氧水溶液与足量KMnO4固体混合,加酸反应,得到1.6g O2.据此判断,甲的观点________(正确或错误),理由是________.
解:(1)要生成氧气,反应物中肯定含有氧元素,除了高锰酸钾以外锰酸钾和二氧化锰中也都含有氧元素,因而多余氧气可能来源于锰酸钾或二氧化锰的进一步分解;氧气具有助燃性,能使带火星的木条复燃,应取一定量的二氧化锰或锰酸钾加热,用带火星的木条检验生成物中是否有氧气.
故答案为:多余氧气可能来源于锰酸钾(或二氧化锰)的进一步分解
取一定量的锰酸钾(或二氧化锰)加热,插入带火星的木条,观察木条是否复燃.
(2)设1.7克过氧化氢完全分解得到氧气的质量为x
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
1.7g x
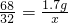
x=0.8g 1.7g过氧化氢完全分解只能得到0.8克氧气,不可能得到1.6克氧气.
故答案为:错误 如果是H2O2催化分解,1.7g的H2O2应得到0.8gO2,而不可能是1.6gO2.
分析:(1)根据化学反应前后元素的种类不变;只要证明该物质受热分解的产物中有氧气就说明该假设成立.
(2)利用过氧化氢制氧气的化学方程式,根据过氧化氢的质量求出氧气的质量.
点评:本道题比较灵活,它考查了学生对所学知识的应用能力,让学生大胆假设,并设计实验证明自己的假设,拓展了学生的思维面.
故答案为:多余氧气可能来源于锰酸钾(或二氧化锰)的进一步分解
取一定量的锰酸钾(或二氧化锰)加热,插入带火星的木条,观察木条是否复燃.
(2)设1.7克过氧化氢完全分解得到氧气的质量为x
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
1.7g x
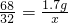
x=0.8g 1.7g过氧化氢完全分解只能得到0.8克氧气,不可能得到1.6克氧气.
故答案为:错误 如果是H2O2催化分解,1.7g的H2O2应得到0.8gO2,而不可能是1.6gO2.
分析:(1)根据化学反应前后元素的种类不变;只要证明该物质受热分解的产物中有氧气就说明该假设成立.
(2)利用过氧化氢制氧气的化学方程式,根据过氧化氢的质量求出氧气的质量.
点评:本道题比较灵活,它考查了学生对所学知识的应用能力,让学生大胆假设,并设计实验证明自己的假设,拓展了学生的思维面.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验室有如下图所示的仪器:

(1)写出下列仪器的名称:
⑥ ,⑧ ;
(2)实验室用加热高锰酸钾的方法制取并用排水法收集几瓶O2气体,若已选用了①、②、⑤、⑨、⑩,还应选用的两种仪器是(填编号): ,发生反应的化学方程式是: ;
(3)实验室制取氧气有以下主要操作步骤:①加热②把药品装入试管后固定在铁架台上③检查装置的气密性④熄灭酒精灯⑤用排水法收集气体⑥从水槽中取出导管.正确的操作顺序是(写序号) ;
(4)若要制取3.2g氧气,请计算:
①高锰酸钾(KMnO4)的相对分子质量为 ,
②要制取3.2g的氧气,需要高锰酸钾的质量为 ;
(5)某同学为了探究催化剂的量对化学反应速率的影响,利用上图中的仪器做了二氧化锰催化过氧化氢分解的一组实验:
①二氧化锰催化过氧化氢分解的化学方程式为 ;
②有关实验数据如下表:
通过对以上实验数据的分析,该实验可以得出的结论是:
Ⅰ ;
Ⅱ .

(1)写出下列仪器的名称:
⑥
(2)实验室用加热高锰酸钾的方法制取并用排水法收集几瓶O2气体,若已选用了①、②、⑤、⑨、⑩,还应选用的两种仪器是(填编号):
(3)实验室制取氧气有以下主要操作步骤:①加热②把药品装入试管后固定在铁架台上③检查装置的气密性④熄灭酒精灯⑤用排水法收集气体⑥从水槽中取出导管.正确的操作顺序是(写序号)
(4)若要制取3.2g氧气,请计算:
①高锰酸钾(KMnO4)的相对分子质量为
②要制取3.2g的氧气,需要高锰酸钾的质量为
(5)某同学为了探究催化剂的量对化学反应速率的影响,利用上图中的仪器做了二氧化锰催化过氧化氢分解的一组实验:
①二氧化锰催化过氧化氢分解的化学方程式为
②有关实验数据如下表:
| 实验组别 | 第1组 | 第2组 | 第3组 | 第4组 | 第5组 | 第6组 |
| MnO2粉末的用量(g) | 0.1 | 0.3 | 0.5 | 0.7 | 0.9 | 1.1 |
| 10%的H2O2溶液的用量(mL) | 30 | 30 | 30 | 30 | 30 | 30 |
| 收集等体积O2所用时间(S) | 17 | 7 | 4 | 2 | 2 | 2 |
Ⅰ
Ⅱ
 2H2O+O2↑ 2KMnO4?K2MnO4+MnO2+O2↑
2H2O+O2↑ 2KMnO4?K2MnO4+MnO2+O2↑