题目内容
【题目】氧气是一种重要的物质,某化学兴趣小组同学设计了多组实验装置测定空气中氧气的含量。
(1)【常规测定】如图1所示的是小明用红磷在空气中燃烧来测定的方法。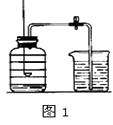
①写出红磷燃烧的化学式表达式: , 属于(填“分解”或“化合”)反应。
②实验完毕,若进入集气瓶中水的体积超过集气瓶中原空气总体积的1/5,你认为导致这一结果的原因可能是(写一条)。
③上面的实验同时证明了氮气的化学性质有(写一条)。
(2)【实验改进】小华同学经过思考,没有使用止水夹,设计出了如右图所示的实验装置。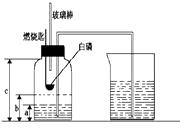
实验过程:
①经检查,装置的气密性良好;
②在集气瓶里装进a体积的水,燃烧匙里放一块白磷(40℃时
白磷即可燃烧),按右图所示装置连接仪器,然后在酒精灯上把玻璃棒下端加热,玻璃棒的作用为;(注:集气瓶内的长导管已接近瓶底)
③把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,现象为(注:白磷与红磷燃烧的产物、现象均相同)
④待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c。
从白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化现象是(填字母序号);
A.上升 B.下降 C.先上升后下降 D.先下降后上升
⑤根据a、b、 c三个数据,计算出空气中氧气的体积分数。已知c=60mL,a=10mL,b=19mL,得出结论,氧气的体积分数为。
(3)实验反思:
①组内成员小张对“实验前集气瓶里要装进a体积的水”非常不理解。咨询了组长小明之后,他终于明白“a 体积的水 ”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二主要是。
②在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值小于理论值的是(填字母序号)。
A.装置气密性不好
B.实验前集气瓶里没有装a体积的水
C.集气瓶没有冷却到室温
D.用红磷代替白磷(红磷的着火点在240℃左右)
(4)【实验拓展】小军同学对实验进行反思后,提出了改进方法(如图2所示 ),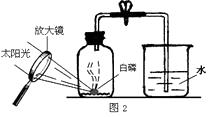
你认为改进后的优点是:(填字母序号)。
A.避免燃烧匙伸入集气瓶过慢带来的误差
B.减少污染,保护环境
【答案】
(1)P+O2![]() P2O5,化合 ,止水夹未夹紧或燃烧匙伸入过慢,不支持燃烧
P2O5,化合 ,止水夹未夹紧或燃烧匙伸入过慢,不支持燃烧
(2)提供热量,引燃白磷 ,白磷燃烧产生大量白烟,D,18%
(3)形成液封,防止实验过程中集气瓶内的气体从长导管中向外逸散而影响实验结果,AC
(4)AB
【解析】(1)红磷燃烧是红磷与氧气点燃条件下反应生成五氧化二磷,该反应符合多变一的特点,属于化合反应;实验完毕后,若进入水大于五分之一,可能是燃烧匙伸入时过慢或止水夹未夹紧;使用过量红磷只消耗五分之一体积的氧气,说明氮气不支持燃烧。
(2)该实验中是利用玻璃的热量引燃白磷,当热玻璃棒接触白磷时,达到白磷的着火点,白磷会燃烧,产生大量白烟;白磷燃烧时放出大量热,使得装置内气体膨胀,水会被压入烧杯中,待反应结束后冷却,因白磷消消耗了氧气使气体体积减小,烧杯中水又被大气压压入到集气瓶中,所以集气瓶内水面先下降后上升;集气瓶中空气的体积为60mL-10mL=50mL,氧气体积即进入水的体积为19mL-10mL=9mL,则氧气的体积分数为![]() 。
。
(3)集气瓶中的水除了降温,使冷却速度加快的作用之外,还起了形成液封,防止实验过程中集气瓶内的气体从长导管中向外逸散而影响实验结果的作用;装置气密性不好和集气瓶没有冷却到室温读数都会使得结果偏小,而实验前集气瓶里没有装a体积的水则会使得反应时气体外逸,结果偏大,用红磷代替白磷,不影响实验结果。
(4)改进装置后,因装置始终密闭可以减小误差,且防止五氧化二磷进入空气减小污染。
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.






