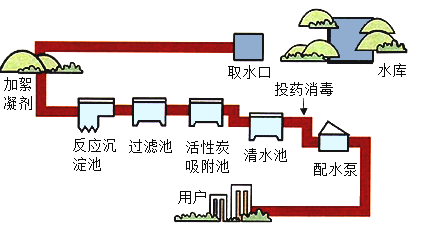
题目内容
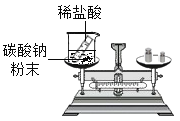
【题目】小松在一次实验中,不小心将稀盐酸滴到水泥板上,发现有大量的气泡产生。查阅资料发现∶水泥板中含有碳酸钙。那么,水泥板与盐酸反应的快慢的影响因素有哪些?小松进行了如下的探究。
(提出假设)
水泥板与盐酸反应的快慢可能与所用的盐酸的质量分数,水泥板颗粒大小有关。
(设计实验)
实验编号 | 5g水泥板规格 | 20ml盐酸的质量分数 | 反应完全所需时间/S |
1 | 粗颗粒 | 20% | 140 |
2 | 粗颗粒 | 10% | 220 |
3 | 细颗粒 | 20% | 30 |
根据以上的信息回答下列问题∶
(1)写出实验室用过氧化氢溶液制氧气的化学方程式∶________________。
(2)实验___________(填实验编号)的目的是为了探究水泥颗粒粗、细对反应快慢的影响。
(3)得出结论∶_______________。
(拓展反思)
(4)小芳认为,本实验也可以用如图装置收集并测量相同体积的二氧化碳,比较所需时间的长短来衡量反应的快慢。其中在水面放一层植物油的目的_______________。量筒的作用是____________。
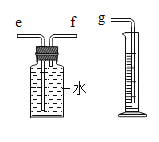
(5)还有哪些因素可能影响反应的速率的快慢呢?请写出你的一个猜想并设计实验来验证:_________。
【答案】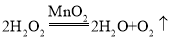 1和3 固体的颗粒越小,反应越快 防止二氧化碳与水反应 根据进入量筒中水的体积,判断生成二氧化碳的体积,收集并测量相同体积的二氧化碳,比较所需时间的长短来衡量反应的快慢 猜测盐酸与水泥板反应的速率快慢与温度有关;实验步骤:取两个试管,分别加入等质量的、纯度相同、颗粒大小相同的水泥板,再分别加入等质量的、质量分数相同的盐酸,一个常温,一个加热到40℃,测定完全反应消耗的时间长短;若常温下完全反应需要的时间较长;则可得出结论:温度越高,反应速率越快。
1和3 固体的颗粒越小,反应越快 防止二氧化碳与水反应 根据进入量筒中水的体积,判断生成二氧化碳的体积,收集并测量相同体积的二氧化碳,比较所需时间的长短来衡量反应的快慢 猜测盐酸与水泥板反应的速率快慢与温度有关;实验步骤:取两个试管,分别加入等质量的、纯度相同、颗粒大小相同的水泥板,再分别加入等质量的、质量分数相同的盐酸,一个常温,一个加热到40℃,测定完全反应消耗的时间长短;若常温下完全反应需要的时间较长;则可得出结论:温度越高,反应速率越快。
【解析】
(1)实验室用过氧化氢溶液制取氧气,反应的化学方程式是: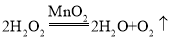 ;
;
(2)实验1和3中,稀盐酸的质量分数相同,水泥板颗粒大小不同,目的是为了探究大理石颗粒粗、细对反应快慢的影响;
(3)得出的实验结论是固体的颗粒越小,反应越快,即反应物的接触面积越大,反应速率越快。
(4)二氧化碳会与水反应,所以在水面上放一层植物油目的是:防止二氧化碳与水反应;量筒的作用是根据进入量筒中水的体积,判断生成二氧化碳的体积。
(5)通常温度越高,化学反应的速率越快,据此猜测盐酸与水泥板反应的速率快慢与温度有关;实验步骤:取两个试管,分别加入等质量的、纯度相同、颗粒大小相同的水泥板,再分别加入等质量的、质量分数相同的盐酸,一个常温,一个加热到40℃,测定完全反应消耗的时间长短;若常温下完全反应需要的时间较长;则可得出结论:温度越高,反应速率越快。

【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
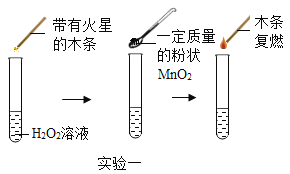
实验一:图中的实验能否证明MnO2是双氧水分解反应的催化剂?并说明理由_______。
实验二:学习了催化剂知识后,某化学探究小组开始了“寻找新的催化剂”研究性实 验:
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | ______________ |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量质量。 | 所得固体质量______g |
IV分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | D试管中产生气泡的速率更快 |
(实验结论)(1)实验________在(填实验步骤的代号,如实验II的代号为“II”)证明:氧化铁可以作过氧化氢分解的催化剂。
(实验评价)
(2)实验设计IV的目的是______;
(3)根据实验IV的现象,你可以得到的结论是:__________。