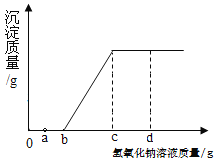
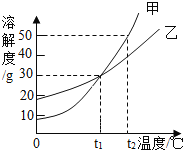
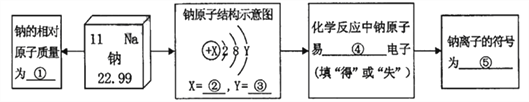
题目内容
【题目】现有某铜锌合金粉末(成分均匀)200 g,取40g后,向其中分四次加入稀硫酸共80g,实验数据见下表:
实验序号 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量 /g | 20 | 20 | 20 | 20 |
产生气体的质量 /g | 0.15 | 0.15 | 0.1 | m |
(1)该铜锌合金粉末属于_____________。(填“纯净物”或“混合物”)
(2)表格中的 m=______________。
(3)200g铜锌合金粉末中共含有锌_____________g。
(4)求稀硫酸的质量分数。(请根据化学方程式写出规范的计算步骤) _________
【答案】混合物 0 65g 36.75%
【解析】
(1)铜锌合金是由铜、锌等两种以上物质混合而成,属于混合物;
(2)由表可知,第1次和第2次,每加入20g稀硫酸,完全反应产生气体的质量都是0.15g,第3次加入20g稀硫酸,产生气体的质量是0.1g,说明第3次,加入20g稀硫酸,稀硫酸过量,40g合金的中的锌完全反应,故第4次加入稀硫酸,不再反应,m=0;
(3)解:设40g铜锌合金中锌的质量为x
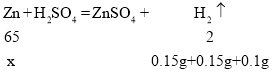
![]() x=13g
x=13g
200g铜锌合金中锌的质量为
![]()
(4)解:设稀硫酸的质量分数为y
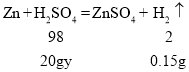
![]() y=36.75%
y=36.75%
答:200g铜锌合金粉末中共含有锌65g;
稀硫酸的质量分数为36.75%。

练习册系列答案
相关题目