题目内容
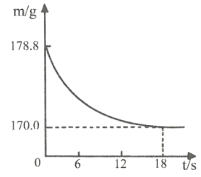
【题目】现有盐酸和氯化铜的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。以下说法正确的是( )
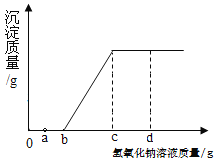
①滴加氢氧化钠溶液的质量至ag时,溶液中含有两种溶质
②滴加氢氧化钠溶液的质量为m(bg<m<cg),此时溶液中发生的化学反应为CuCl2+2NaOH═Cu(OH)2↓+2NaCl
③滴加氢氧化钠溶液的质量至dg时,溶液pH>7
④在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量先减小后不变
A. ②③B. ①②③C. ③④D. ②③④
【答案】A
【解析】
向其中逐滴滴入氢氧化钠溶液,氢氧化钠先和盐酸反应生成氯化钠和水,后和氯化铜反应生成蓝色沉淀氢氧化铜和氯化钠。
①滴加氢氧化钠溶液的质量至ag时,溶液中含有三种溶质,即没有反应的氯化铜、剩余的氯化氢和反应生成的氯化钠,该选项说法不正确;
②滴加氢氧化钠溶液的质量为m(bg<m<cg),此时溶液中发生的化学反应为CuCl2+2NaOH═Cu(OH)2↓+2NaCl,该选项说法正确;
③滴加氢氧化钠溶液的质量至dg时,氢氧化钠溶液过量,溶液pH>7,该选项说法正确;
④在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量始终不变,该选项说法不正确。
故选:A。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15
【题目】现有某铜锌合金粉末(成分均匀)200 g,取40g后,向其中分四次加入稀硫酸共80g,实验数据见下表:
实验序号 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量 /g | 20 | 20 | 20 | 20 |
产生气体的质量 /g | 0.15 | 0.15 | 0.1 | m |
(1)该铜锌合金粉末属于_____________。(填“纯净物”或“混合物”)
(2)表格中的 m=______________。
(3)200g铜锌合金粉末中共含有锌_____________g。
(4)求稀硫酸的质量分数。(请根据化学方程式写出规范的计算步骤) _________