题目内容
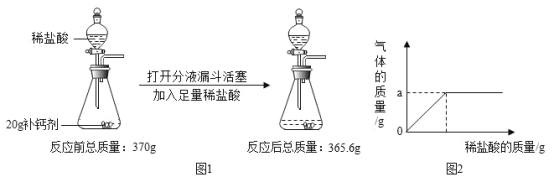
【题目】回收硫酸铜废液中的铜,取12.8kg铁粉与硫酸铜废液混合,充分反应,过滤、洗涤、干燥,得到的固体能被磁铁吸引;再将该固体与过量的稀硫酸充分反应,过滤、洗涤、干燥,得固体12.8kg,不能被磁铁吸引。整个过程中参加反应的CuSO4与H2SO4的质量之比
A.80:7B.80:49C.10:7D.8:7
【答案】A
【解析】
取12.8kg铁粉与硫酸铜废液混合,铁与硫酸铜反应生成硫酸亚铁和铜,充分反应后,过滤、洗涤、干燥,得到的固体能被磁铁吸引,说明铁粉有剩余,再将该固体与过量的稀硫酸充分反应,铁与稀硫酸反应生成硫酸亚铁和氢气,铜与稀硫酸不反应,过滤、洗涤、干燥,得固体12.8kg,不能被磁铁吸引,说明铁已经完全反应,得到的固体是铜,故铁与硫酸铜反应生成铜的质量是12.8kg。
设参加反应的硫酸铜的质量为x,与硫酸铜反应的铁的质量为y
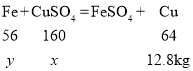
![]() x=32kg
x=32kg
![]() y=11.2kg
y=11.2kg
故与稀硫酸反应的铁的质量为:12.8kg-11.2kg=1.6kg
设参加反应的硫酸的质量为z
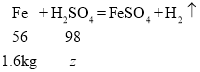
![]() z=2.8kg
z=2.8kg
故参加反应的硫酸铜与硫酸的质量比为:32kg:2.8kg=80:7
故选A。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】在探究氢氧化钙与稀盐酸中和反应实验时,忘记了滴加酚酞溶液,无法判断反应进行到何种程度,同学们决定对反应后溶液中溶质的成分进行探究.写出该化学反应的方程式____________________.
(提出问题)反应后溶液中的溶质是什么?
(做出猜想)猜想一:CaCl2和Ca(OH)2猜想二:CaCl2和HCl 猜想三:______
请将猜想三补充完整,并说出你猜想的理由是______.
(设计方案)
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞试液 | ______ | 猜想一不正确 |
②另取少量反应后的溶液于试管中, 滴加_______________ | 有气泡产生 | 猜想二正确 |
(拓展与应用)该实验后的溶液不能直接排放到下水道,原因是________________。