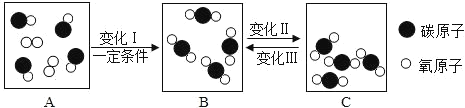
题目内容
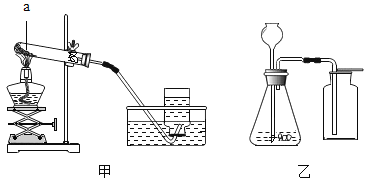
【题目】某兴趣小组用两支规格相同的注射器与一支具支试管对“测定空气中氧气的含量”的实验装置进行了改进(如图)。
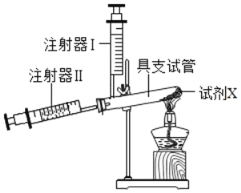
具体实验步骤如下:
步骤一:装配仪器(但不加入药品),使注射器I中不留空气,注射器Ⅱ中留有一定体积空气,检查装置气密性。
步骤二:在具支试管中加入足量的试剂X,塞上橡胶塞,记录注射器Ⅱ中气体体积(记为V1)
步骤三:用酒精灯加热,交替推动两注射器的活塞。
步骤四:停止加热,冷却至室温。将注射器I中的气体全部挤入具支试管,待注射器Ⅱ的活塞稳定后,读取并记录气体体积(记为V2)。
步骤五:实验结束后,清洗仪器。将具支试管装满水并塞上塞子,使注射器I和Ⅱ中均无气体或液体残留。将试管中的水倒入量筒,测定体积(记为V3)
(1)步骤一中检查装置气密性的方法是:_____。
(2)步骤二中加入的试剂X可能是_____(填序号)
①硫粉 ②碳粉 ③铜粉
(3)步骤三中,交替推动两注射器的活塞目的是_____。
(4)根据测定数据可以计算空气中氧气的体积分数为_____(用V1、V2、V3表示)
【答案】连接装置,推或拉任一注射器活塞,松手后活塞回到原处,说明装置不漏气 ③ 使空气流动,保证氧气完全反应 ![]()
【解析】
硫在氧气中点燃生成二氧化硫,碳在氧气中点燃生成二氧化碳,铜在氧气中加热生成氧化铜。
(1)步骤一中检查装置气密性的方法是连接装置,推或拉任一注射器活塞,松手后活塞回到原处,说明装置不漏气。
(2)硫粉和碳粉在空气中需要点燃,且生成物为气体,铜粉不需要点燃,加热就能和氧气反应,生成物氧化铜为固体,步骤二中加入的试剂X可能是铜粉,故选③。
(3)步骤三中,交替推动两注射器的活塞目的是使空气流动,保证氧气完全反应。
(4)空气中氧气的体积为![]() ,空气的体积为
,空气的体积为![]() ,故空气中氧气的体积分数为
,故空气中氧气的体积分数为![]() 。
。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出一定量的溶液作为待测液进行如下探究.
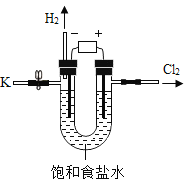
老师提示:
I.电解饱和食盐水的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
实验步骤 | 实验现象 | 实验结论 |
____________________ | ________________ | 待测液中含有氢氧化钠. |
探究活动二:测定待测液中氢氧化钠的质量分数
(实验1)用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(2)写出待测液中的氢氧化钠与稀盐酸反应的化学方程式:________________________.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据计算所称取待测液中氢氧化钠的质量时,应选用稀盐酸的体积为_______________mL.
(实验2)用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
取待测液称重 ②加入足量氯化镁溶液 ③过滤出沉淀物 ④洗涤沉淀 ⑤干燥称重
乙组同学按如图所示的实验步骤进行实验:
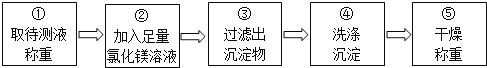
(4)步骤②加入的氯化镁溶液必需足量,其目的是____________________.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:___________________________(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是____________.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将 ________(选填“偏大”、“偏小”或“没影响”).
【题目】化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?

【提出猜想】佳佳认为溶质是Na2CO3
贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
实验操作 | 实验现象 | 实验结论 |
①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量 | ① ② | 贝贝的猜想成立 |
【实验反思】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH,.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是 .
【题目】甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 | 检测结果 | |
甲同学 | 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 | pH>7 |
乙同学 | 将pH试纸直接浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 | pH>7 |
(1)碳酸钠的化学式为__________,它属于________(填酸、碱、盐、氧化物)
(2)根据两位同学的实验可得出碳酸钠溶液酸碱性的结论:__________________
(3)根据两位同学的实验操作,你认为_________同学操作不规范。为什么?_____________。
(4)如果实验室没有pH试纸,又要一次测定未知溶液的酸碱性,可选用__________试液来进行实验。