题目内容
【题目】沙东化工厂的废水中含有HCl和FeCl3再无其他杂志.小明同学采集了该废水样品80.7g,向其中滴加20%的NaOH溶液至溶液沉淀完成时消耗该NaOH溶液80g.待溶液冷至常温,测得其pH=7.将生成的沉淀滤出,经水洗,干燥后称重为10.7g.
(1)上述废水样品反应后所得的溶液中,溶质是(写化学式,下同)___,溶剂是___,阴、阳离子所带的负电荷总数和正电荷总数之比为____.
(2)已知上述反应后的溶液在常温下为不饱和溶液,请计算其中溶质的质量分数____.
【答案】NaCl H2O 1:1 其中溶质的质量分数15.6%
【解析】
(1)氢氧化钠和盐酸反应生成氯化钠和水,氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,上述废水样品反应后所得的溶液中,溶质是氯化钠,化学式为NaCl,溶剂是水,阴、阳离子所带的负电荷总数和正电荷总数之比为1:1;
(2)设反应后的溶液中NaCl质量为x
由HCl+NaOH=NaCl+H2O 和 FeCl3+3NaOH=3NaCl+Fe(OH)3↓,得:
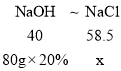
![]()
x=23.4g
所得溶液质量为:80.7g+80g-10.7g=150g
反应后溶液中NaCl的质量分数为:23.4g÷150g×100%=15.6%
答:反应后的溶液中溶质的质量分数为15.6%。

练习册系列答案
相关题目
【题目】某实验小组用氯酸钾和二氧化锰为原料制取氧气,反应过程中测量的有关数据记录如下:
反应时间(min) | 0 | 1 | 2 | 3 | 4 |
试管中固体质量(g) | 14.25 | 12.65 | 11.05 | 9.45 | 9.45 |
(1)反应到______min时,氯酸钾就完全分解。
(2)反应完全时生成氧气的质量为________。
(3)原固体中氯酸钾的质量是_________?