题目内容
【题目】某项目学习小组进行了如下探究。
(查阅资料)导电率越大,溶液导电性越强,离子浓度越大。
鸡蛋壳主要成分是CaCO3,其他成分对实验影响忽略不计。
鸡蛋壳与牙齿和含氟牙膏反应的化学原理相似。
(实验一)鸡蛋沉浮
将一个新鲜的鸡蛋放在盛有足量稀盐酸的烧杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。
(1)冒气泡的原因____________________________________________________ (化学方程式表示)。
(2)接近液面时又下沉的原因__________________________________________
(实验二)
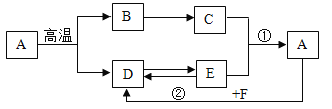
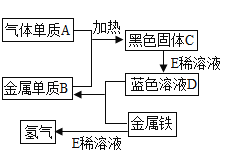
鸡蛋壳溶解在烧杯中加入蒸馏水,插入电导率传感器,加人蛋壳粉,搅拌,测得电导率随时间的变化如图一。
(3) 搅拌的目的是__。
(4) 图1中,a-b段电导率变化的原因__,b-c段电导率基本不变的原因__。
(实验三)鸡蛋壳代替牙齿探究含氟牙膏能否预防龋齿
(5)直资料知,含氟牙膏(含氟成分为NaF)与蛋壳反应在表而生成氟化钙保护层。反应的化学方程式为:_________。
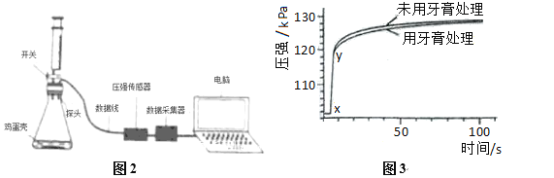
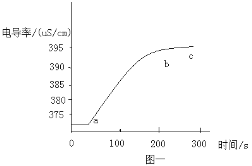
(6) 先检查图2装置气密性,方法是___________。 再称取0.50g“牙膏处理过的蛋亮(用牙膏液浸泡、洗涤、晾干)”于锥形瓶中,用注射器抽取20mL3.5%的盐酸(模拟形成龋齿的酸境),连接好装置,打开开关,将盐酸快速压入锥形瓶,关闭开关,测得压强随时间的变化如图3所示。用“未用牙膏处理的蛋壳”重复上述实验。
(7) 图3中x-y段压强增大的主要原因_____________________。
(8) 根据实验三的数据分析,含氟牙膏_____(填“能”或“不能”)预防龋齿,理由________________________________________________________________________________________________________________________
【答案】CaCO3+2HCl CaCl2 + CO2↑+ H2O气泡破裂,浮力减少(类似合理答案均给分)增大接触面积,加快溶解速率,充分溶解蛋壳中部分CaCO3逐渐反应溶解,溶液中离子浓度增大; 溶质溶解接近饱和,离子浓度则基本不变CaCO3+2NaF CaF2 + Na2CO3打开开关,拉动(或“推动”也可)注射器活塞,松开后,活塞回到原位,说明气密性良好(类似合理答案均给分)碳酸盐与盐酸反应产生了CO2气体,使瓶内压强增大能相同条件下,使用含氟牙膏处理后的鸡蛋壳,反应能产生的气体更少,压强更小,消耗的鸡蛋壳更少(类似合理答案均给分)
【解析】
实验一:
(1).盐酸和鸡蛋中含有的碳酸钙会发生反应,产生二氧化碳氯化钙和水
(2).下沉的原因可能是物体变重,或者浮力变小。根据题分析可知,只能是浮力变小,故可能是气泡破裂。
实验二:
(3)搅拌是为了把沉淀在下面的蛋壳粉和盐酸充分接触。
(4).蛋壳中部分CaCO3逐渐反应溶解,溶液中离子浓度增大;导电性和离子的浓度有关,而物质在溶液中的溶解度是一定的,故不能无限的增加
实验三:
(5). CaCO3+2NaF CaF2 + Na2CO3
(6).常见的检查气密性的方法都是造成封闭体系,然后利用气压差使内外液面不平,或者产生气泡,还有注射器的可以恢复等方法。
(7)气压增大的方法有三种,增加气体的量、升高温度、压缩体积(只有一个变化时),分析题目可知,本题是产生二氧化碳气体。
(8) 分析图像可知,使用含氟牙膏处理后的鸡蛋壳,反应能产生的气体更少,压强更小,消耗的鸡蛋壳更少

【题目】最近,西南五省市持续严重干旱,保护水环境、珍爱水资源,是每个公民应尽的责任和义务。请回答下列问题
(1)不论是河水还是海水,你认为保持水的化学性质的最小粒子是________。下列能确认水是由氧元素和氢元素组成的实验是________(填序号)。
A.水的蒸馏 | B.水的蒸发 | C.水的电解 | D.水的净化 |
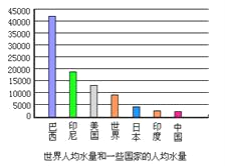
(2)下图是某些国家的人均水量和世界人均水量(m3/人)。由图中可以看出我国是一个水资源________的国家。举出你在生活中节约用水的一点做法:________;
(3)有一杯主要含有MgCl2和CaCl2的硬水。某兴趣小组设计出软化水的部分实验方案,请你一起来完成。可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水
实验步骤 | 现 象 | 结论或化学方程式 |
①取少量水样于试管中,向其中滴加 Ca(OH)2溶液,直到不再产生沉淀 | 有白色沉淀产生 | MgCl2+Ca(OH)2=Mg(OH)2 ↓+CaCl2 |
②继续向上述试管中滴加________ , 直到不再产生沉淀 | 有白色沉淀产生 | 化学方程式:________ |
③过滤 | 滤液澄清 | |
④取上述滤液少许于试管中,滴加少量________ ,振荡 | ________ | 证明硬水已软化 |