题目内容
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
(1)m=
(2)试计算这种石灰石矿中碳酸钙的质量分数.
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
4.4
4.4
;(2)试计算这种石灰石矿中碳酸钙的质量分数.
分析:取稀盐酸200 g,平均分成4份进行实验,每次实验使用稀盐酸50g;
根据实验结果数据表,5g石灰石完全反应可以生成二氧化碳1.54g,若15g石灰石完全反应生成二氧化碳质量=1.54g×3=4.62,而实验中仅放出4.4g二氧化碳,说明此时石灰石没有完全反应,没有完全反应是由于稀盐酸不足;
计算石灰石中碳酸钙的质量分数=
×100%,因此,在选择实验数据进行计算时,要选择碳酸钙完全反应的实验,否则会因碳酸钙未能完全反应而计算结果偏小;
根据实验结果数据表,5g石灰石完全反应可以生成二氧化碳1.54g,若15g石灰石完全反应生成二氧化碳质量=1.54g×3=4.62,而实验中仅放出4.4g二氧化碳,说明此时石灰石没有完全反应,没有完全反应是由于稀盐酸不足;
计算石灰石中碳酸钙的质量分数=
| 石灰石矿中碳酸钙的质量 |
| 石灰石 |
解答:解:(1)当石灰石质量为15g时,就因50g稀盐酸量不足而石灰石没完全反应,所以,石灰石增加到20g时,50g稀盐酸依然量不足,所以此时产生二氧化碳的质量仍然为4.4g,也就是m值为4.4;
故答案为:4.4;
(2)解:设这种石灰石矿中碳酸钙的质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g×x 1.54g
=
解之得:x=70%
答:该这种石灰石矿中碳酸钙的质量分数为70%.
故答案为:4.4;
(2)解:设这种石灰石矿中碳酸钙的质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g×x 1.54g
| 100 |
| 5g×x |
| 44 |
| 1.54g |
解之得:x=70%
答:该这种石灰石矿中碳酸钙的质量分数为70%.
点评:本题考查根据化学方程式进行计算,要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等,进行认真地选择或解答,本题关键是判断反应是否完全.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
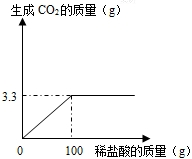 某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.