题目内容
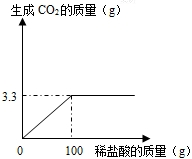 某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.问:(1)10g样品可以产生多少克二氧化碳
(2)该样品中碳酸钙的质量分数
(3)一吨该石灰石可制成多少吨生石灰.(已知:CaCO3高温CaO+CO2↑)
分析:(1)图中曲线不再上升,并保持水平时对应的纵坐标数值即为产生二氧化碳的质量.
(2)由二氧化碳和样品质量根据碳酸钙与盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数.
(3)由石灰石的质量和碳酸钙的质量分数根据碳酸钙高温分解的化学方程式可以计算出生成生石灰的质量.
(2)由二氧化碳和样品质量根据碳酸钙与盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数.
(3)由石灰石的质量和碳酸钙的质量分数根据碳酸钙高温分解的化学方程式可以计算出生成生石灰的质量.
解答:解:(1)由图中曲线可知:曲线不再上升并保持水平时,对应的纵坐标数值为3.3g,这个数值即为产生二氧化碳的质量.
(2)设样品中碳酸钙的质量分数为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10g×x 3.3g
=
,x=75%
(3)设生成生石灰的质量为y.
CaCO3
CaO+CO2↑
100 56
1t×75% y
=
,y=0.42t
答:(1)产生3.3g二氧化碳.
(2)样品中碳酸钙的质量分数为75%.
(3)生成生石灰0.42t.
(2)设样品中碳酸钙的质量分数为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10g×x 3.3g
| 100 |
| 44 |
| 10g×x |
| 3.3g |
(3)设生成生石灰的质量为y.
CaCO3
| ||
100 56
1t×75% y
| 100 |
| 56 |
| 1t×75% |
| y |
答:(1)产生3.3g二氧化碳.
(2)样品中碳酸钙的质量分数为75%.
(3)生成生石灰0.42t.
点评:本题主要考查含杂质物质的化学方程式计算,难度较大.计算时注意:
第一、从图中分析出生成二氧化碳的质量.
第二、由二氧化碳的质量来计算样品中碳酸钙的质量分数.
第三、计算生石灰质量时要考虑石灰石不纯.
第一、从图中分析出生成二氧化碳的质量.
第二、由二氧化碳的质量来计算样品中碳酸钙的质量分数.
第三、计算生石灰质量时要考虑石灰石不纯.

练习册系列答案
相关题目