题目内容
【题目】为了测定某稀硫酸的溶质的质量分数,设计了如图1实验方案。
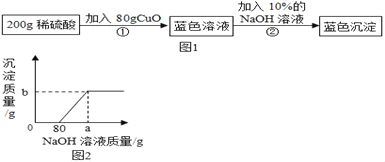
第②步实验测得的部分数据见图2:
(1)分析第②步实验:首先与80g NaOH溶液反应的物质是_____(填化学式)
(2)计算稀硫酸的溶质的质量分数是多少?_____(写出具体计算过程)
(3)a的读数为_____,b的读数为_____。
(4)将最后得到的蓝色沉淀经洗涤、烘干后,充分加热得到黑色固体CuO质量为_____。
【答案】H2SO4 53.9% 880 98 80g
【解析】
解:(1)加入氢氧化钠溶液开始没有沉淀,说明氢氧化钠溶液先和硫酸反应生成硫酸钠和水,继续加入NaOH溶液,氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀;
(2)设氧化铜消耗硫酸的质量为x,生成硫酸铜的质量为y
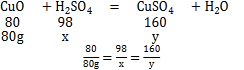
x=98g
y=160g
氢氧化钠消耗的硫酸的质量为z,
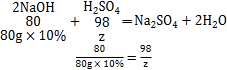
z=9.8g
稀硫酸的溶质的质量分数![]() ×100%=53.9%
×100%=53.9%
所以稀硫酸的溶质的质量分数为53.9%;
(3)设硫酸铜消耗氢氧化钠溶液的质量为w,生成氢氧化铜沉淀的质量为h。
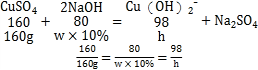
w=800g
h=98g
所以a的数值为800g+80g=880g,b的数值为98g;
(4)氧化铜和硫酸反应生成硫酸铜和水,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,氢氧化铜加热生成氧化铜和水,以及铜元素守恒可知,充分加热得到黑色固体CuO质量为80g。
故答案为:(1)H2SO4;(2)53.9%;(3)880,98;(4)80g。

练习册系列答案
相关题目