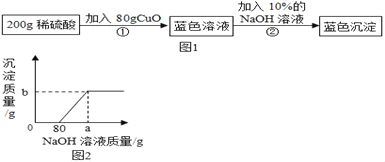
题目内容
【题目】牙膏是人们生活中的必需品,在牙膏生产过程中常添加一种摩擦剂.这种摩擦剂是一种经过一系列加工而制得的极细的碳酸钙粉末.其生产过程如图.
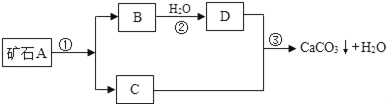
根据上图回答:
(1)写出B,C,两种物质的化学式:B_____; C_____;
(2)写出上述过程中反应①的化学方程式_____.上述过程中没有涉及的基本反应类型是_____
(3)许多牙膏中都含有_____元素,因为如果缺少这种元素,就容易得龋齿.
【答案】(1)CaO; CO2;(2)CaCO3![]() CaO+CO2↑. 置换反应和复分解反应
CaO+CO2↑. 置换反应和复分解反应
(3)氟
【解析】
试题(1)由图可知,矿石A能生成B和C,则A可能是碳酸钙,生成的B和C可能为氧化钙和二氧化碳,B能和水反应生成D,D与C反应生成和碳酸钙和水,则D为氢氧化钙,C为二氧化碳,B为氧化钙,化学式为CaCO3,CaO,CO2,Ca(OH)2;(2)碳酸钙分解生成氧化钙和二氧化碳属于分解反应,化学方程式为:CaCO3![]() CaO+CO2↑.反应②为氧化钙与水化合生成氢氧化钙,属于化合反应,反应③是二氧化碳与氢氧化钙反应生成碳酸钙和水,此反应不属于基本反应类型,因此该过程中没有涉及到的反应类型为复分解反应和置换反应(3)氟元素能防治龋齿,如果缺少氟元素就容易得龋齿,因此许多牙膏中都含有氟元素
CaO+CO2↑.反应②为氧化钙与水化合生成氢氧化钙,属于化合反应,反应③是二氧化碳与氢氧化钙反应生成碳酸钙和水,此反应不属于基本反应类型,因此该过程中没有涉及到的反应类型为复分解反应和置换反应(3)氟元素能防治龋齿,如果缺少氟元素就容易得龋齿,因此许多牙膏中都含有氟元素

【题目】小华将一张滤纸在某示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
A | B | C | D | |
滤纸上的指示剂 | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
烧杯中的溶液 | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
A. A
B. B
C. C
D. D
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
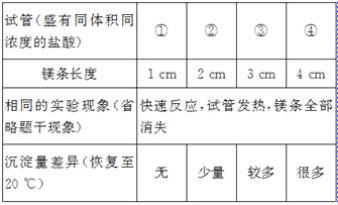
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
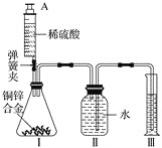
【题目】某化学兴趣小组根据右图所示进行模拟炼铁的实验,并对产物成分进行探究。
经初步无色气体A不含有单质气体,黑色粉末B含有两种单质中的一种或者两种。
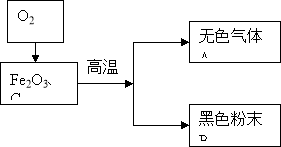
高炉炼铁的原理为:Fe2O3+3CO![]() 2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。
2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。
兴趣小组又分成甲乙两组分别对无色气体A和黑色粉末B的成分进行探究。
【猜想与假设】
甲组在分析了炼铁的原理后,认为无色气体A中可能有CO2,也可能有未反应的 。
乙组认为黑色粉末的成分中存在以下三种情况:
假设一:只含有铁。 假设二:只含有 。 假设三:以上两种物质都含有。
【实验探究】
(1)为验证甲组的猜想,大家按下图示进行实验(箭头表示气体流向):
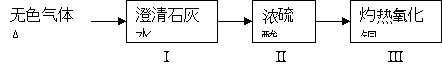
当看到Ⅰ中澄清石灰水变浑浊,Ⅲ中灼热的氧化铜变红,可以确定无色气体A的成分为: ,Ⅱ中浓硫酸的作用是: 。
(2)为验证乙组中假设三成立,大家用物理和化学两种方法来进行探究
实验方法 | 实验操作 | 实验现象 | 实验结果 |
物理方法 | 假设三成立 | ||
化学方法 | 取少量黑色粉末B于试管中,加入过量的稀盐酸 | 假设三成立 |
写出黑色粉末B中加入过量的稀盐酸反应的化学方程式: 。
【交流反思】
在做甲组的实验中发现其存在一个很不环保的缺陷,请指出来 。