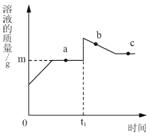
题目内容
【题目】某实验小组为探究酸的化学性质,由甲、乙、丙同学设计并完成了如图所示的实验。
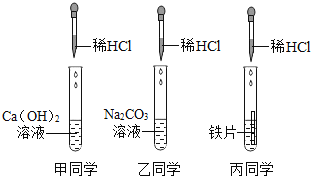
[在阅资料] CaCl2、NaCl 的溶液是中性,Na2CO3溶液显碱性。
[实验探究一]确定甲、乙同学上述实验后所得溶液中的溶质。
(1)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是__(写化学式)
(2)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是___。(写化学式)
[实验探究二]确定甲、乙同学上述实验所得溶液混合后的成分。
(3)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到先有气泡产生,后有白色沉淀生成。该白色沉淀是____(写化学式)。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
[提出猜想]
(4)甲同学猜想: NaCl
乙同学猜想: NaCl、CaCl2;
丙同学猜想: NaCl、CaCl2、 HCl ;
你的猜想:______。
[交流讨论]
(5)你认为___同学的猜想一定不正确,理由是______。
[设计实验]
(6)请设计实验证明你的猜想正确。
实验现象 | 实验结论 | 实验步骤 |
取少量滤液于试管中,向其中滴加_____ | ______ | 猜想成立。 |
【答案】CaCl2、HCl NaCl、Na2CO3 CaCO3 NaCl、Na2CO3 丙 有盐酸就不会有白色沉淀 氯化钙溶液 有白色沉淀生成
【解析】
(1)氢氧化钙与盐酸反应生成氯化钙和水,取甲所得溶液少许,加入石蕊试液,溶液显红色,说明溶液呈酸性,盐酸过量,甲所得溶液中一定含有的溶质是氯化钙、氯化氢;化学式为:CaCl2、HCl;
(2)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,取乙所得溶液少许,加入酚酞试液,溶液显红色,说明溶液呈碱性,碳酸钠溶液过量,乙所得溶液中一定含有的溶质是氯化钠和碳酸钠;化学式为:NaCl、Na2CO3;
(3)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,甲、乙同学把上述实验所得溶液倒入同一废液缸中,碳酸钠先与盐酸反应,等盐酸完全消耗后再与氯化钙反应,所以观察到先有气泡产生,后有白色沉淀生成,该白色沉淀是碳酸钙,化学式为:CaCO3;
(4)甲同学猜想NaCl;乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;根据(3)分析可知,当碳酸钠过量,溶液中溶质的成分是NaCl、Na2CO3;
(5)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,丙同学的猜想一定不正确,理由是有盐酸就不会有白色沉淀;
(6)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。检验碳酸钠溶液存在可用氯化钙溶液。实验证明我的猜想:取少量滤液于试管中,向其中滴加氯化钙溶液,有白色沉淀生成,猜想成立。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请你参与探究并回答问题。
(提出猜想)假设l:红色粉末是铜粉; 假设2:红色粉末是氧化铁粉; 假设3:红色粉末是____。
(实验探究)某同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按下图装置在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
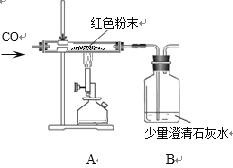
反应前 | 反应后 | |
Ⅰ组 | 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0 g | 洗气瓶和瓶中物质的总质量为183.1 g |
(交流讨论)
(1)应该选择___________组的实验数据来计算确定组成.最终计算结果表明:该红色粉末的组成是假设____(填序号)成立。
(2)写出A装置中发生反应的化学方程式________________________;实验中观察到A装置中的现象为____________________。
(3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?请判断并说明理由:________________________________。
(反思评价)
(1)从环保角度,该装置有严重不足之处。你认为应该如何改进?____________________。
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是_________________________。
(3)工业上用2000t含氧化铁75%的赤铁矿,可炼出含铁97%的生铁_________________吨?(结果保留一位小数)
【题目】甲、乙、丙三种物质的转化关系如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是
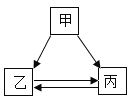
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2O | H2 |
B | NaOH | NaCl | NaNO3 |
C | C | CO2 | CO |
D | Ca (OH) 2 | CaCl2 | CaCO3 |
A.AB.BC.CD.D