题目内容
【题目】(10分)小强将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后有气泡冒出。他对所产生气体的成分及排水口洗净剂主要成分进行探究。
【探究活动一】
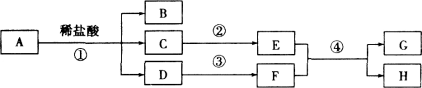
老师提示:排水口洗净剂与水作用的生成物中有两种常见的气体。小强设计并进行如下图所示的实验。

实验现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此得出结论:生成的两种气体分别是: 和 。B中有关反应的化学方程式为 。
【探究活动二】
老师提供了一瓶过碳酸钠(Na2CO4),引导小强进行如下实验探究:

根据上述实验结果得出结论:无色溶液x中含有的一种溶质是 。根据质量守恒定律,小强对溶液x中还可能存在其它溶质作出如下猜想:
①Na2CO3 ②NaHCO3 ③Na2CO3和NaHCO3的混合物。
资料摘要I:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2= CaCO3↓+ 2NaC1
资料摘要Ⅱ:NaHCO3溶液呈碱性;碳酸氢钠、碳酸钠分别与足量的酸反应产物相同。
实验验证:
实验步骤 | 实验现象 | 实验结论 |
a、取上述无色溶液X少量于试管中,至不再冒气泡为止,加入足量的氯化钙溶液 | 产生白色沉淀 | 无色溶液X中含有 |
b、取步骤a所得上层清液少量,滴加 | 无色溶液X中不含 |
综合上述两个探究活动的结果,小强明确了上述猜想 (填序号)是正确的。
【答案】【探究活动一】二氧化碳 氧气 CO2+Ca(OH)2=CaCO3↓+H2O
【探究活动二】过氧化氢
实验步骤 | 实验现象 | 实验结论 |
Na2CO3 | ||
稀盐酸 | 没有气泡产生 | NaHCO3 |
①
【解析】
试题分析:【探究活动一】根据信息B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此得出结论:生成的两种气体分别是:二氧化碳和氧气,B中的澄清石灰水变浑浊反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O
【探究活动二】根据在溶液中加入MnO2,就迅速冒出气泡,故无色溶液x中含有的一种溶质是过氧化氢
要探究对溶液x中还可能存在其它溶质:Na2CO3、NaHCO3;应抓住它们的化学性质,根据资料摘要I:氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2= CaCO3↓+ 2NaC1,故a、取上述无色溶液X少量于试管中,加入足量的氯化钙溶液,现象:产生白色沉淀,结论:无色溶液X中含有Na2CO3;
再根据资料摘要Ⅱ:NaHCO3溶液呈碱性;碳酸氢钠、碳酸钠分别与足量的酸反应产物相同,说明碳酸氢钠与盐酸反应生成二氧化碳,故b、取步骤a所得上层清液少量,滴加稀盐酸,因为实验结论是不含碳酸氢钠,故现象应是没有气泡产生
综合上述两个探究活动的结果,溶液x中只含碳酸钠,明确了上述猜想①

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案