题目内容
【题目】将一定质量的金属锌投入到63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求(计算结果精确到0.1%):
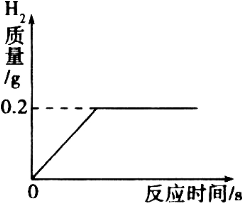
(1)完全反应后生成氢气的质量为________g;
(2)所用稀硫酸中溶质的质量分数;
(3)反应结束后所得溶液的质量.
【答案】(1)0.2 (2)15.4% (3)70g
【解析】(1)由放出气体的质量与反应时间的关系图可知,生成氢气的质量为0.2g.
(2)设参加反应的锌、稀硫酸中溶质的质量分别为x、y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
![]()
![]() g
g
![]()
![]() g
g
所用稀硫酸中溶质的质量分数为![]() .
.
(3)由质量守恒定律可知,反应结束后所得溶液的质量为:63.7g+6.5g-0.2g=70g.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目