题目内容
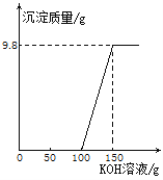
【题目】(9分)电镀厂的废水中含有H2SO4和CuSO4,为了回收Cu(OH)2并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如下图所示。请回答:
(1)K2SO4属于 肥;
(2)求所用的KOH溶液的溶质质量分数;
(3)若每天处理200吨废水,可制得 吨K2SO4。
【答案】(1)钾(2)22.4%(3)(3)52.2吨
【解析】
试题分析:)K2SO4含有钾元素属于化肥中的钾肥;
设50g溶液中含KOH的质量为x。
CuSO4+2KOH==Cu(OH)2↓+K2SO4
112 98
x 9.8g
![]() x=11.2g
x=11.2g
所用的KOH溶液的溶质质量分数:![]()
处理200g废水用KOH溶液150克,所以处理200吨废水,需要KOH溶液150吨,其中含氢氧化钾的质量=150吨×22.4%,根据质量守恒定律可以知道其中的钾元素=150吨×22.4%×39/56×100%完全转化为硫酸钾,设X吨K2SO4含有的钾元素和其相等。150吨×22.4%×39/56×100%=X×78×/174×100% X=0.3×174 X=52.2吨。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】除去下列各物质中少量杂质的方法,不合理的是
选项 | 物质 | 所含杂质 | 除去杂质方法 |
A | CO2 | CO | 通过足量的灼热氧化铜 |
B | N2 | O2 | 通过足量的灼热的铜网 |
C | FeSO4 | CuSO4 | 溶解、加过量铁粉、过滤、蒸发 |
D | NaCl | KNO3 | 溶解、降温结晶、过滤 |