题目内容
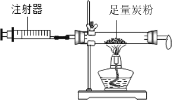
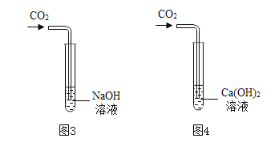
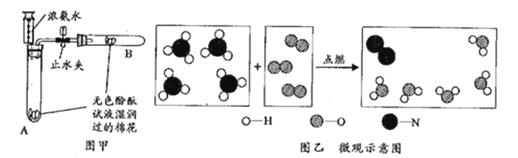
【题目】化学兴趣小组同学利用图1装置制备干燥的二氧化碳气体并探究其性质,实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
(1)组装好实验装置,加药品前应先进行的操作是______,装置A中甲的名称是______。装置B中盛装的试剂是______。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)碳酸盐与二氧化碳、水反应生成可溶于水的碳酸氢盐。
(提出假设)
假设1:挥发出的HCl使浑浊变澄清。反应的化学方程式是______。
假设2:碳酸钙与二氧化碳、水反应生成可溶于水的碳酸氢钙,从而浑浊变澄清。
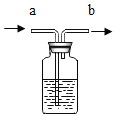
(设计实验)为除去CO2中的HCl,小组同学在图1中增加图2装置,装置2中盛装的试剂是______(填选项序号)。
A.浓硫酸 B.NaOH溶液
C.饱和Na2CO3溶液 D.饱和 NaHCO3溶液
(实验现象)饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
(得出结论)由以上探究可得出结论______。
(3)该兴趣小组在老师指导下,用PH传感器测得图1烧杯中溶液的PH随通入二氧化碳的变化曲线如图
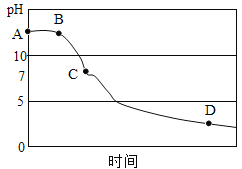
BC段产生的现象是______。参加反应的化学方程式为______。
【答案】检验装置气密性 分液漏斗 浓硫酸 CaCO3+2HCl=CaCl2+H2O+CO2↑ D 二氧化碳只能使饱和石灰水生成的沉淀部分溶解,挥发出的氯化氢气体能使饱和的石灰水生成的沉淀溶解变澄清 有白色沉淀生成 CO2+Ca(OH)2═CaCO3↓+H2O、Ca(OH)2+2HCl═CaCl2+2H2O
【解析】
(1)组装好实验装置,加药品前应先进行的操作是检验装置气密性,故填检验装置气密性;由图示可知,装置A中甲的名称是分液漏斗,故填分液漏斗;装置B中盛装的试剂是浓硫酸,浓硫酸具有吸水性,可以干燥生成的二氧化碳气体,故填浓硫酸;
(2)
[提出假设]
假设1:挥发出的HCl使浑浊变澄清,是由于氯化氢气体溶于水生成的稀盐酸能与碳酸钙反应生成了氯化钙、二氧化碳和水,反应的化学方程式故填CaCO3+2HCl=CaCl2+H2O+CO2↑;
[设计实验]
A、浓硫酸具有吸水性,但不和稀盐酸反应,不能除去二氧化碳中的氯化氢,故不符合题意;
B、氢氧化钠溶液既能和氯化氢反应,也能和二氧化碳反应生成碳酸钠和水,故不符合题意;
C、碳酸钠溶液既能和氯化氢反应生成氯化钠、水和二氧化碳,也能和二氧化碳、水反应生成碳酸氢钠,故不符合题意;D、碳酸氢钠溶液能和氯化氢反应生成氯化钠、水和二氧化碳,且不和二氧化碳反应,符合除杂的原则,故符合题意,故填D;
[得出结论]
饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清,而挥发出来的氯化氢使饱和石灰水产生的浑浊最终变澄清,故填二氧化碳只能使饱和石灰水生成的沉淀部分溶解,挥发出的氯化氢气体能使饱和的石灰水生成的沉淀溶解变澄清;
(3)由图示可知,反应刚开始时排出空气,pH值几乎不变,生成的二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,挥发出的氯化氢与氢氧化钙反应生成氯化钙和水,所以BC段中溶液pH减小,且有白色沉淀生成,故填有白色沉淀生成;化学方程式故填CO2+Ca(OH)2═CaCO3↓+H2O、Ca(OH)2+2HCl═CaCl2+2H2O。

 开心蛙状元测试卷系列答案
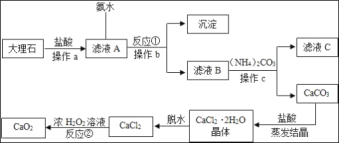
开心蛙状元测试卷系列答案【题目】碳酸锂作为锂的基础锂盐,广泛用于玻璃制造和陶瓷生产过程中的添加剂,也是制备锂电池的重要原料。碳酸锂在热水中的溶解度很小,工业上以锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质)为原料制取碳酸锂的硫酸法生产工艺流程如下
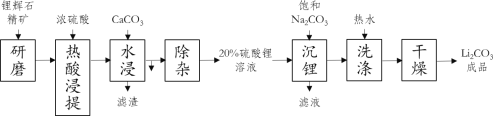
(1)锂辉石热酸浸提前要进行“研磨”,其目的是_____
(2)“水浸”中加入CaCO3的作用之一是为了调节pH=5,让溶液中的Al3+变成Al(OH)3沉淀出来,要确定溶液的pH值为5,可以用pH试纸来测定,其操作方法是_____
(3)“沉锂”中加入的Na2CO3溶液是饱和溶液,其作用是_____,反应的化学方程式为_____
(4)“洗涤”中使用热水,原因是_____,证明洗涤干净的方法是_____
(5)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,锂元素浸出率的数据如下表
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①本实验中,编号为_____两组实验能说明温度对锂元素浸出率的影响
②根据上表数据,MgSO4用量对锂元素浸出率的影响是_____
③在工业生产过程中,相当数量的硫酸和纯碱变成了价值较低的Na2SO4等物质,从而造成了生产成本的提高,为了降低生产成本,除了尽可能减少硫酸的配量外,降低能源消耗也是一个方面,因此,可以继续设计实验,以探究出最佳锂元素浸提工艺条件,下列设计合理的是_____(填字母)
A 矿酸比1:2,硫酸浓度98,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98,MgSO4用量1.25,温度200℃
C 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度200℃
D 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度250℃