题目内容
【题目】含有铝粉l.8g、锌粉6.5g、铁粉11.2g、铜粉3.8g的混合物与一定质量的稀硫酸充分反应后,有6.6g金属剩余,则生成氢气的总质量为________g;其中产生氢气质量最多的反应的化学方程式为________。
【答案】0.7 Fe+H2SO4= FeSO4+H2↑
【解析】
四种金属的活动性顺序为:铝>锌>铁>氢>铜,铜不与硫酸反应,且将金属混合物放入硫酸后,铝先与硫酸反应,然后是锌,最后是铁,含有铝粉l.8g、锌粉6.5g、铁粉11.2g、铜粉3.8g的混合物与一定质量的稀硫酸充分反应后,有6.6g金属剩余,说明剩余铁的质量为6.6g-3.8g=2.8g,
设铝生成氢气的质量为x,锌生成氢气的质量为y,铁生成氢气的质量为z

![]() x=0.2g
x=0.2g
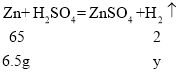
![]() x=0.2g
x=0.2g
参加反应的铁:11.2g-2.8g=8.4g

![]() x=0.3g
x=0.3g
生成氢气的总质量为0.7g,其中铁生成氢气最多。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】课外兴趣小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
(1)(假设)H2O2生成O2的快慢与催化剂种类有关;
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
(2)(进行实验)如图是他们进行实验的装置图。请写出过氧化氢在二氧化锰的催化下发生反应的化学方程式_____。在B位置最好选用_____法来收集氧气(选填“向上排空气法”或“排水法”),长颈漏斗下端管口应插在_____(选填“液面上”或“液面下”)。
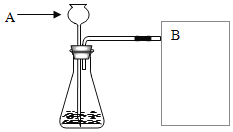
(3)(实验记录)
实验编号 | 1 | 2 |
反应物 | 5%H2O2 | 5%H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165秒 | 46秒 |
(4)(结论)该探究过程得出的结论是_____。
(5)(反思)H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和_____是否改变。按照你所填写的内容来设计一个实验方案验证:_____。