题目内容
化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理.请你一起参与探究.
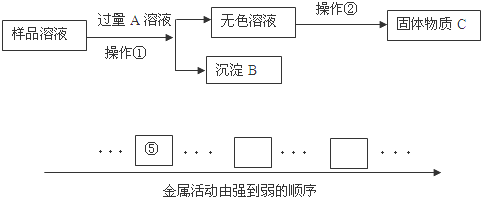
(1)实验依据:金属活动顺序.请在下表对应的方框内填入铁和铜的元素符号.
(2)意外发现:小明将光亮的铁丝插入含Fe2(SO4)3和CuSO4的废液中,一段时间后取出,意外地发现铁丝表面没有变红.
(3)提出问题:Fe为什么没有从废液中置换出Cu?
(4)提出假设:小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.
(5)验证假设:提供的主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的Fe2(SO4)3溶液三份[Fe2(SO4)3溶液显黄色].
| 实验操作 | 实验现象和数据 | 结论 |
| ①准确称量洁净的铁丝和铜丝的质量 | 铁丝质量为ag, 铜丝质量为bg | \ |
| ②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铁丝质量为mg,(m<a),溶液有黄色变为浅绿色 | 一定有 生成(填化学式) |
| ③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铜丝质量为ng(n<b) | 铜 (填“能”或“不能”)与Fe2(SO4)3溶液反应 |
| ④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 | 铁丝质量较轻 铜丝质量不变 | Fe、Cu共存时 优先与Fe2(SO4)3溶液反应 |
(6)实验结论:小丽的假设 (选填“成立”或“不成立”),理由是 ;
(7)思考与交流:
①兴趣小组的同学们通过对上述实验的分析,找到了用Fe从含Fe2(SO4)3和CuSO4的溶液中提取金属Cu的关键,并且最终实验获得了成功,其实验成功的关键是: .并且反应充分.
②已知Fe和Fe2(SO4)3发生化合反应.请按反应顺序写出用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的化学方程式: ; .
(1)Fe Cu; (5)②FeSO4 ③能 ④Fe
(6)不成立;Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应
(7)①加入过量的铁 ②Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
解析试题分析:(1)熟记金属活动性顺序表,并会写元素符号,故答案为:Fe Cu;
(5)②根据反应后铁丝的质量减少了,并且溶液由黄色变为浅绿色,确定为硫酸亚铁溶液,故答案为:FeSO4
③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量,铜丝质量为ng(n<b),铜能与Fe2(SO4)3溶液反应,故答案为:能;
④根据实验后的现象“铁丝质量较轻,铜丝质量不变”得知Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,故答案为:Fe;
(6)用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu,实验过程Fe没有从废液中置换出Cu,小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.但是根据实验探究的结果发现Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,所以小丽的假设错误的,故答案为:不成立;Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应;
(7)①根据实验探究的结果,我们得知铁先于硫酸铁溶液反应生成硫酸亚铁,所以只有加入过量的铁才能发生铁与硫酸铜溶液的置换反应,从而生成铜,故答案为:加入过量的铁;
②已知Fe和Fe2(SO4)3发生化合反应,且生成的是浅绿色的溶液;铁与硫酸铜溶液的反应属于置换反应是教材上学过的反应方程式,故答案为:Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
考点:实验探究物质的性质或变化规律;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
点评:本题联系生产实际以实验探究的形式,重在考查金属的化学性质,虽难度稍大,但仍是一道不错的化学题.

为探究铁和铜的金属活动性顺序,请根据实验室现有的仪器和药品条件(如下所列),通过填写下表,完成对实验方案的构思。
【实验仪器】试管、胶头滴管、镊子
【实验药品】铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液
| 方案 | 所选药品 | 有关化学方程式 |
| 1 | | |
| 2 | | |
(11分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示: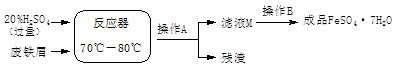
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有: ; 。
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等。
将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化二铁和另两种氧化物,试写出该反应的化学方程式 。
兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
(1)将金属R投入稀盐酸中,金属表面有气泡冒出.则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
(2)为了比较金属R与铁的活动性强弱,兴趣小组设计下列方案进行实验,请完成下表:
| 你的一种猜想 | 验证方法 | 现象 | 结论 |
| 金属R的活动性比铁 | 将金属R投入 溶液中 | 金属R表面有黑色的物质析出 | 猜想 (选填“正确”或“错误”) |