题目内容
17、海水是一种化学成分复杂的混合物,包括水、溶解于水中的多种化学元素和气体.在海水中迄今已发现的化学元素达80多种.含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、硼、氟等.
(1)写出有关元素的元素符号:碳
(2)海水中的氯元素和钠元素主要以钠离子和氯离子形式存在,请用化学符号表示:钠离子
(3)选择H、O、Cl、Ca、Mg五种元素中的适当元素,组成符合下列要求的物质,将化学式填写在空格中:
一种酸:
一种金属氧化物:
(4)由海水蒸发制得的食盐中,常含有Na2SO4、CaCl2等杂质,这些杂质对后续生产有害,需要去除.要除去Na2SO4,一般使用BaCl2,化学方程式为:
要除去CaCl2,一般使用Na2CO3,化学方程式为:
(1)写出有关元素的元素符号:碳
C
;硫S
;钙Ca
;钾K
.(2)海水中的氯元素和钠元素主要以钠离子和氯离子形式存在,请用化学符号表示:钠离子
Na+
;氯离子Cl-
;氯化钠NaCl
.(3)选择H、O、Cl、Ca、Mg五种元素中的适当元素,组成符合下列要求的物质,将化学式填写在空格中:
一种酸:
HCl
;一种难溶的碱:Mg(OH)2
;一种盐CaCl2(MgCl2)
;一种金属氧化物:
CaO (MgO)
; 一种非金属单质H2(O2 Cl2)
.(4)由海水蒸发制得的食盐中,常含有Na2SO4、CaCl2等杂质,这些杂质对后续生产有害,需要去除.要除去Na2SO4,一般使用BaCl2,化学方程式为:
Na2SO4+BaCl2=BaSO4↓+2NaCl
;要除去CaCl2,一般使用Na2CO3,化学方程式为:
CaCl2+Na2CO3=CaCO3↓+2NaCl
.分析:根据元素符号、离子符号、化学式、化学方程式书写方法正确书写.化学式书写时正价在前、负价在后、正负化合价代数和为零.化学方程式书写时要遵循质量守恒定律.
解答:解:(1)元素符号只有一个字母的要大写,两个字母的一大一小,故元素的元素符号为:碳 C;硫 S;钙 Ca;钾 K.
(2)离子符号在元素符号右上角注明所带电荷数与正负号,故离子符号为钠离子Na+;氯离子Cl-;氯化钠NaCl.
(3)根据给定元素,结合酸、碱、盐、氧化物的定义及组成正确写出.酸是电离时电离出的阳离子全部是氢离子的化合物,碱是电离时电离出的阴离子全部是氢氧根离子的化合物,盐是由金属阳离子和酸根阴离子构成的化合物;氧化物是由两种元素组成,其中一种是氧元素的化合物,故一种酸:HCl;一种难溶的碱:Mg(OH)2;
一种盐 CaCl2(MgCl2;一种金属氧化物:CaO (MgO); 一种非金属单质.H2(O2 Cl2)
(4)硫酸钠与氯化钡反应生成硫酸钡和氯化钠,化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl;氯化钙与碳酸钠反应生成碳酸钙和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl
故答案为:(1)C; S; Ca; K.
(2)Na+; Cl-; NaCl.
(3)HCl; Mg(OH)2; CaCl2(MgCl2);
:CaO (MgO); H2(O2 Cl2).
(4)Na2SO4+BaCl2=BaSO4↓+2NaCl; CaCl2+Na2CO3=CaCO3↓+2NaCl.
(2)离子符号在元素符号右上角注明所带电荷数与正负号,故离子符号为钠离子Na+;氯离子Cl-;氯化钠NaCl.
(3)根据给定元素,结合酸、碱、盐、氧化物的定义及组成正确写出.酸是电离时电离出的阳离子全部是氢离子的化合物,碱是电离时电离出的阴离子全部是氢氧根离子的化合物,盐是由金属阳离子和酸根阴离子构成的化合物;氧化物是由两种元素组成,其中一种是氧元素的化合物,故一种酸:HCl;一种难溶的碱:Mg(OH)2;
一种盐 CaCl2(MgCl2;一种金属氧化物:CaO (MgO); 一种非金属单质.H2(O2 Cl2)
(4)硫酸钠与氯化钡反应生成硫酸钡和氯化钠,化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl;氯化钙与碳酸钠反应生成碳酸钙和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl
故答案为:(1)C; S; Ca; K.
(2)Na+; Cl-; NaCl.
(3)HCl; Mg(OH)2; CaCl2(MgCl2);
:CaO (MgO); H2(O2 Cl2).
(4)Na2SO4+BaCl2=BaSO4↓+2NaCl; CaCl2+Na2CO3=CaCO3↓+2NaCl.
点评:明确元素符号、离子符号、化学式、化学方程式书写原则及物质分类是解答本题关健.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目

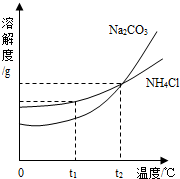 (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
 (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题: