题目内容
南海是我国的固有领海,南海蕴藏着丰富的海洋资源.(1)我国科学家在南海海底发现了一种蕴藏量极大的新型矿产资源--天然气水合物,它是天然气(主要成分是CH4)和水形成的冰状固体,极易燃烧,又称“可燃冰”.它被认为是一种清洁能源,原因是______.
(2)从海水中提取单质镁的过程如下图所示:

在上述转化过程中,所发生的化学反应属于复分解反应的是______(填反应顺序标号).
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
①t1℃时,NH4Cl的溶解度______ Na2CO3的溶解度(填“大于”“小于”“等于”之一).
②t2℃时,Na2CO3饱和溶液的溶质质量分数______NH4Cl饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).
③t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的NaOH固体加入烧杯内的水中,小试管内的固体物质逐渐溶解,原因是______.

【答案】分析:(1)根据可燃冰的优点考虑;(2)根据复分解反应的特点:两种化合物相互交换成分生成两种新的化合物的反应类型;(3)①根据某一温度时物质溶解度的比较方法考虑;②根据饱和溶液的质量分数的计算考虑;③根据氢氧化钠溶于水放热考虑.
解答:解:(1)因为可燃冰燃烧放出的热量多,燃烧产物是二氧化碳和水,不污染环境所以被认为是一种清洁能源;
(2)第①个反应是氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,属于复分解反应,第②是氢氧化镁与盐酸反应生成氯化镁和水,属于复分解反应;
(3)①从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时,NH4Cl的溶解度大于Na2CO3的溶解度;
②饱和溶液的质量分数: ×100%,又因为t2℃时,Na2CO3的溶解度等于NH4Cl的溶解度,所以饱和溶液的质量分数也相等;
×100%,又因为t2℃时,Na2CO3的溶解度等于NH4Cl的溶解度,所以饱和溶液的质量分数也相等;
③氢氧化钠溶于水放热,所以使溶液温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
故答案为:(1)燃烧产物是水和二氧化碳,不污染环境;(2)①②;(3)①大于;②等于;③氢氧化钠溶于水放出热量,温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
点评:解答本题关键是要知道可燃冰的燃烧产物,复分解反应的定义,溶解度大小的判断,饱和溶液的质量分数的计算.
解答:解:(1)因为可燃冰燃烧放出的热量多,燃烧产物是二氧化碳和水,不污染环境所以被认为是一种清洁能源;
(2)第①个反应是氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,属于复分解反应,第②是氢氧化镁与盐酸反应生成氯化镁和水,属于复分解反应;
(3)①从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时,NH4Cl的溶解度大于Na2CO3的溶解度;
②饱和溶液的质量分数:
 ×100%,又因为t2℃时,Na2CO3的溶解度等于NH4Cl的溶解度,所以饱和溶液的质量分数也相等;
×100%,又因为t2℃时,Na2CO3的溶解度等于NH4Cl的溶解度,所以饱和溶液的质量分数也相等;③氢氧化钠溶于水放热,所以使溶液温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
故答案为:(1)燃烧产物是水和二氧化碳,不污染环境;(2)①②;(3)①大于;②等于;③氢氧化钠溶于水放出热量,温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
点评:解答本题关键是要知道可燃冰的燃烧产物,复分解反应的定义,溶解度大小的判断,饱和溶液的质量分数的计算.

练习册系列答案
相关题目


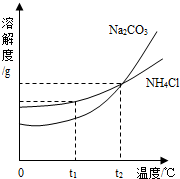 (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:

