题目内容
金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是 (填序号).
| A.金属的硬度 | B.金属的导电性; |
| C.金属的耐腐蚀性 | D.金属价格与硬币面值的吻合度. |
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁酸钠中铁元素的化合价为 价.
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是 (填序号).
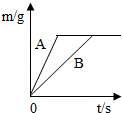
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等
(1)B;(2)铁>铜>金或Fe>Cu>Au;(3)+6;(4)①③⑤.
解析试题分析:(1)根据硬币的流通特点可知:铸造出的硬币要有较强的耐腐蚀性、硬度较大、且硬币价值与面值的吻合度要接近,而金属的导电性不是铸造硬币所考虑的因素;
(2)金属活动性越强,越容易生锈,由“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少,可知铁最活泼,铜次之,金最不活泼.所以,三种金属的活动顺序由强到弱的顺序是 铁>铜>金;
(3)设铁元素化合价为X则:(+1)×2+x+(﹣2)×4=0解得x=+6;
(4)由已知:“等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”进行分析:
①锌的活动性比铁的活动性强,所以等质量的金属,锌反应的时间短,所以A表示锌反应的曲线,故①正确;
②由图示可知:生成的氢气的质量相等,所以硫酸均反应完;Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,由方程式分析可知:如果锌恰好反应,则铁有剩余,所以反应结束后消耗两种金属的质量不相等;故②错误;
③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸均反应完;故③正确;
④由图示可知:生成的氢气的质量相等,所以硫酸均反应完;Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,由方程式分析可知:如果锌恰好反应,则铁有剩余,或者两种金属都有剩余,故④错误;
⑤由图示可知:生成的氢气的质量相等,故⑤正确.
即①③⑤正确.
考点:金属的物理性质及用途;金属的化学性质;金属活动性顺序及其应用;有关元素化合价的计算.
点评:本题结合图象对金属与酸的反应进行了细致的考查,能很好的考查学生对知识的掌握和应用能力,要结合相关知识认真分析.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
| 实验步骤 | 实验现象 | 结 论 |
| | | 金属活动性:Fe>Cu |
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]①三个反应的共同特点是 ,写出其中一个反应的化学方程式 .
②若完全反应后,三个反应生成氢气的质量相等,原因是 .
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
| 操作 | 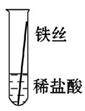 | 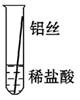 | 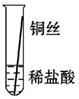 | 根据现象得出金属活动性顺序 |
| 片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 | |
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是________。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操作 | 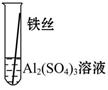 | 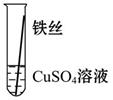 | 根据现象得出金属活动性顺序 |
| 现象 | 无明显现象 | | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式_________________。
【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为________________。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序________________。


