题目内容
铁、铜、铝、锌是生产生活中常用的金属.
(1)铝能制成铝箔是因为铝具有良好的 性;
(2)在金属活动性顺序中,铁、铜、铝、锌由强到弱排列的顺序是 (填元素符号).
(3)任写出一个稀盐酸与上述金属能发生反应的化学方程式: ,反应前后金属元素的化合价 (填“不变”、“升高”或“降低”).
(1)延展; (2)Al Zn Fe Cu; (3)Zn+2HCl═ZnCl2+H2↑,升高.
解析试题分析:(1)铝能制成铝箔是因为铝具有良好的延展性.
(2)金属活动性顺序是:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,利用此表的信息,金属活动性顺序由强到弱的顺序依次是Al Zn Fe Cu;
(3)在金属活动性顺序中,只有排在氢前面的金属才能与酸反应产生氢气;在单质中元素的化合价是零,在化合物中,金属元素一般显正价,所以金属与酸反应后,金属元素的化合价升高了。
考点:金属的物理性质及用途;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
点评:此题所考知识点较多,重点考查了金属的性质以及金属活动性顺序的应用,是中考的考点.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是 (填序号).
| A.金属的硬度 | B.金属的导电性; |
| C.金属的耐腐蚀性 | D.金属价格与硬币面值的吻合度. |
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁酸钠中铁元素的化合价为 价.
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是 (填序号).
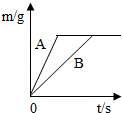
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等