题目内容
(2008?扬州)2007年诺贝尔物理奖授予了法国科学家阿尔贝?费尔和德国科学家彼得?格林贝格尔,以表彰他们发现巨磁电阻效应.该成果推动了磁信息材料的发展,MgFe2O4是一种磁信息材料,广泛应用于电子计算机.则MgFe2O4中Fe的化合价为( )
【答案】分析:根据化合物中各元素的化合价代数和为0,利用物质的化学式MgFe2O4及Mg、O元素化合价分别为+2、-2,计算化合物中Fe元素的化合价.
解答:解:设在化合物MgFe2O4中Fe元素化合价为x,根据化合物中各元素的化合价代数和为0,则(+2)+x×2+(-2)×4=0解得x=+3
故选C.
点评:利用物质的化学式,根据化合物中各元素的化合价代数和为0,可计算化合物中某元素的化合价.
解答:解:设在化合物MgFe2O4中Fe元素化合价为x,根据化合物中各元素的化合价代数和为0,则(+2)+x×2+(-2)×4=0解得x=+3
故选C.
点评:利用物质的化学式,根据化合物中各元素的化合价代数和为0,可计算化合物中某元素的化合价.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
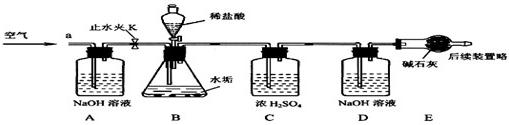
(2008?扬州)化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答问题.
[查阅资料]天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见表
[提出猜想]水垢的主要成分中一定含有______和______,可能含有Ca(OH)2和MgCO3(填化学式).
[设计方案]实验1:确定水垢中是否含Ca(OH)2和CaCO3
实验2:确定水垢中是否含MgCO3利用下列实验装置,完成实验2探究.其主要实验步骤发下:
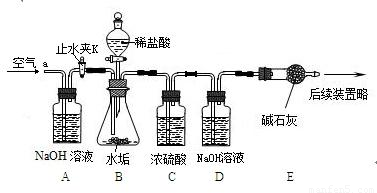
称量D、E装置总质量为600.00g,按上图组装后,将2.50g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为601.25g(碱石灰主要成分为CaO和NaOH,不考虑装置内空气对实验的影响).
[实验讨论](1)加入样品前还应______,装置B中盛放稀盐酸的仪器名称为______,装置C的作用是______,反应结束后打开止水夹K,缓缓鼓入空气的目的是______,装置A的作用是______,A、B装置之间设置干燥装置(填:“要”、“不要”),______理由是______.
(2)装置B中生成气体的化学方程式为______(只要求写一种),装置D中的化学方程式为______.
(3)装置B中生成CO2的质量为______g.通过计算说明水垢中______含MgCO3(填字母).
A. 一定B. 一定不C. 可能D. 无法确定
计算过程(已知物质相对分子质量 CaCO3:100 MgCO3:84):
实验3:确定水垢中是否含有Mg(OH)2另取质量为2.50g的水垢,加入3.65%的稀盐酸与之反应,测得消耗稀盐酸w g..结合以上实验结论,判断w的值满足______条件时,水垢中一定含有Mg(OH)2(请通过计算说明).
[查阅资料]天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见表
| 部分钙、镁化合物溶解性表(20℃) | |||
| 阴离子阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
[设计方案]实验1:确定水垢中是否含Ca(OH)2和CaCO3
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入 Na2CO3溶液. | 没有白色沉淀产生 | ______ |

称量D、E装置总质量为600.00g,按上图组装后,将2.50g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为601.25g(碱石灰主要成分为CaO和NaOH,不考虑装置内空气对实验的影响).
[实验讨论](1)加入样品前还应______,装置B中盛放稀盐酸的仪器名称为______,装置C的作用是______,反应结束后打开止水夹K,缓缓鼓入空气的目的是______,装置A的作用是______,A、B装置之间设置干燥装置(填:“要”、“不要”),______理由是______.
(2)装置B中生成气体的化学方程式为______(只要求写一种),装置D中的化学方程式为______.
(3)装置B中生成CO2的质量为______g.通过计算说明水垢中______含MgCO3(填字母).
A. 一定B. 一定不C. 可能D. 无法确定
计算过程(已知物质相对分子质量 CaCO3:100 MgCO3:84):
实验3:确定水垢中是否含有Mg(OH)2另取质量为2.50g的水垢,加入3.65%的稀盐酸与之反应,测得消耗稀盐酸w g..结合以上实验结论,判断w的值满足______条件时,水垢中一定含有Mg(OH)2(请通过计算说明).