题目内容
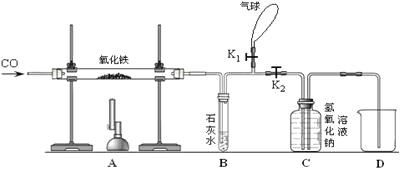
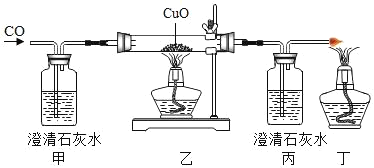
【题目】某兴趣小组为了研究露置于空气中的纯净生灰石(CaO)的变质情况,进行了如下实验:
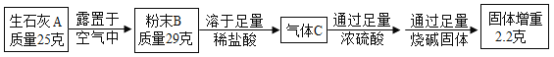
下列结论正确的是( )
A. A转化为B过程中钙元素的质量分数逐渐增大B. 若无浓硫酸,则粉末B中CaO质量测定值偏小
C. 粉末B中Ca(OH)2质量为5.0 gD. A到B中生石灰的变质程度为33.6%
【答案】B
【解析】
A、根据质量守恒定律,A转化为B过程中钙元素的质量不变,B质量增加,钙元素的质量分数逐渐减小,故错误;
氢氧化钠增加的质量即为二氧化碳的质量,为2.2g;
设碳酸钙的质量为x
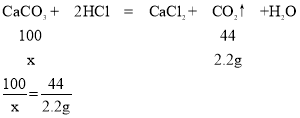
x=5g
设这些CaCO3是由质量为y的CaO转化而来,
由CaO+H2O═Ca(OH)2,Ca(OH)2+CO2═CaCO3↓+H2O可知,CaO~CaCO3,

y=2.8g
2.8g氧化钙转化成5g碳酸钙后,固体质量增加:5g-2.8g=2.2g,因此氧化钙除部分转化成碳酸钙外,还有一部分转化成氢氧化钙,
设转化成氢氧化钙的质量为z,转化成氢氧化钙的氧化钙的质量为m

z=7.4g,m=5.6g
未变质的生石灰的质量为:25g-2.8g-5.6g=16.6g;
B、浓硫酸具有吸水性,如无浓硫酸,氢氧化钠固体质量增加的质量不一定全是二氧化碳的质量,则粉末B中CaO质量测定值偏小,故正确;
C、粉末B中Ca(OH)2的质量为7.4克,故错误;
D、A到B中生石灰的变质程度=![]() ×100%=24.3%,故错误。
×100%=24.3%,故错误。
故选:B。

练习册系列答案
相关题目