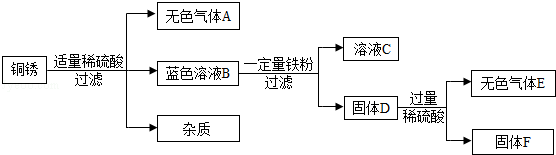
题目内容
同学们即将初中毕业.在离开母校之际,整理自己的物品时,若清理出如下物品:①废作业纸 ②易拉罐 ③变质饼干 ④生锈铁钉。
(1)应该放入“不可回收垃圾箱”的是 (用序号填写)。
(2)生锈铁钉可用酸除锈,把一根生锈放入过量稀盐酸中,过一会儿,可看到现象是 ,此时溶液中的阳离子有 ;过一段时间,还会看到铁钉表面有 产生,产生该现象的化学方程式为 。
(3)X、Y、Z是金属活动性顺序表中的三种固态金属,如果把X、Y、Z分别放入稀硫酸中,X溶解并产生氢气,Y、Z不反应;把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,回答下列问题:
①X、Y和Z的金属活动性由强到弱的顺序为 ;
②写出在Z表面有银析出的反应化学方程式 。
(1)③;(2)铁锈溶解溶液变黄;H+、Fe3+;Fe+2HCl=FeCl2+H2↑;
(3)①X>Z>Y;②Cu+2AgNO3=2Ag+Cu(NO3)2(合理即可)
解析试题分析:(1)根据垃圾回收与分类知识可知:①废作业纸 ②易拉罐 ④生锈铁钉均属可回收资源,而③变质饼干属于生活垃圾不可回收;
(2)铁锈的主要成分是氧化铁,氧化铁能与盐酸反应生成氯化铁,氯化铁的溶液呈黄色,故现象是铁锈溶解溶液变黄;由于盐酸过量所以此时溶液中含有的阳离子是H+、Fe3+;当铁锈完全反应后铁又能够与盐酸反应生成氢气和氯化亚铁,反应的方程式为Fe+2HCl=FeCl2+H2↑;
(3)①根据在金属活动性顺序中,排在氢前面的金属能与酸反应置换出氢气,排在后面的则不能。由于把Z和X分别放入稀硫酸中,X溶解并产生氢气,Z不反应,说明X比Z的活动性强;而把Y和Z分别放入硝酸银溶液中,在Z表面有银析出,而Y没有变化,说明Z的活动性比Y强,故三金属的活动性强弱关系是:X>Z>Y。
②活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来。由于只有金属X在氢前,因此X可以是在金属活动性顺序中氢前的金属,而Z在银前面,Y在银后面,因此Z是铜和汞中的一种,而Y是铂和金的一种。
考点:考查酸的化学性质;金属活动性顺序及其应用

人类的生产生活离不开金属。
(1)在地壳里含量最多的金属元素是 。
(2)我国是世界上最早使用湿法炼铜的国家,其反应原理是 。(用
化学方程式表示)。下列铜制品的用途中,利用金属导电性的是 (填字母)。
| A.铜火锅 | B.铜导线 | C.铜钟 | D.铜钱 |
露在空气中也容易被锈蚀的,铜锈的化学式为Cu2(OH)2CO3,其
生锈的条件与铁有相似之处,另外,还可能与空气中的 有关。
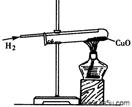
(4)下图是实验室用氢气还原氧化铜实验的示意图。实验结束后,某同学发现试管里红色的物质又变成黑色,原因是 。
人们的日常生活离不开金属。请回答下列问题:
(1)奥运场馆“鸟巢”使用了大量的钢铁,钢铁与 直接接触容易生锈造成损失,在钢铁表面涂油、刷漆等,都能防止钢铁生锈。
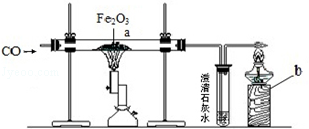
(2)实验室用图示实验模拟炼铁反应的原理。
①a处可观察的现象是 ;
②b处点燃酒精灯的目的是 ;
③为确保实验安全,在通入一氧化碳之前应该 。
(3)置换反应是化学反应的基本类型之一。非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:C12+2NaBr=2NaCl+Br2;I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2由此可判断:
①S、C12、I2、Br2活动性由强到弱顺序是 。
②下列化学方程式书写错误的是 。
| A.C12+2NaI=2NaCl+I2 | B.I2+2KBr=2KI+Br2 |
| C.Br2+Na2S=2NaBr+S↓ | D.C12+K2S=2KCl+S↓ |