题目内容
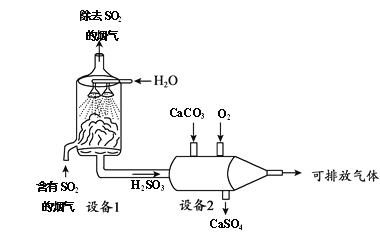
【题目】课外小组同学利用下图所示装置制取二氧化碳,并对其性质进行研究。A中盛有大理石,注射器中装有足量的稀盐酸,B中盛有浓硫酸,C中①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球。
(1)检查装置气密性:打开a,用手捂住A瓶外壁,若观察到B中导管口有气泡冒出,说明装置A____________(填“漏气”或“不漏气”)。
(2)A中发生反应的化学方程式为__________________________________。
(3)C中能说明二氧化碳密度大于空气且能与水反应的现象是_______________,二氧化碳与水反应的化学方程式为______________。
【答案】 不漏气 CaCO3+2HCll![]() CaCl2+CO2↑+H2O ④比①先变红,②、③不变红 CO2+H2O
CaCl2+CO2↑+H2O ④比①先变红,②、③不变红 CO2+H2O![]() H2CO3
H2CO3
【解析】(1)检查装置气密性:打开a, 用手捂住A瓶外壁(使A微热),若观察到B中导管口有气泡冒出,说明装置A不漏气;(2)A中发生反应是碳酸钙和稀盐酸反应生成二氧化碳、水、和易溶于水的氯化钙,化学方程式为CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;
(3)C中能说明二氧化碳密度大于空气且能与水反应的现象是④比①先变红,②、③不变红,二氧化碳与水反应生成碳酸,化学方程式为CO2+H2O=== H2CO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】阅读下面科普短文。
在中国古代化工发展的历史征程中,我国古代先民们在火药、制陶烧瓷、炼铜冶铁等化学加工技术方面取得了许多非凡的成就,为促进我国古代社会发展和人类的进步做出了重大的贡献。
【火药】人类最早使用的火药是黑火药,主要反应如下:

【制陶烧瓷】瓷器与陶器,都属于硅酸盐系列制品,最主要的化学成分是二氧化硅(SiO2)、氧化铝(Al2O3)及多种金属(Ca、Mg、Fe、K、Na等)氧化物。但在化学成分含量、用途等方面却大有区别。
制品 | 化学成分 | 性能用途等 |
陶器 | Al2O3 约15%~18%; Fe2O3约5%~6%; CaO、MgO等≥3%。 | 粗糙,不够坚硬,常用于取水、盛放食物等。 |
瓷器 | Al2O3 约18%~28%; Fe2O3约1%~2%; CaO、MgO等≤1%。 | 高温烧结,坚硬致密,洁白,薄, 呈半透明,敲击时清脆悦耳,美观,用途广泛,观赏、收藏价值高等。 |
【金属冶炼】制陶发展起来的高温技术为金属的冶炼、熔铸创造了条件,我国由新石器时代晚期逐步进入了先是炼铜(称为“青铜器时代”)后是炼铁(称为“铁器时代”)的金属时代。
青铜冶炼
天然铜夹杂在铜矿石之中,人们在加热熔化天然铜的过程中,将绿色的孔雀石[Cu2(OH)2CO3]、棕或黑色的锡石(SnO2)、蓝色的方铅矿(PbS)放在一起烧,便产生了青铜。青铜是铜与锡或铅熔成的合金。熔点比纯铜(1083℃)低100℃~300℃,更易加工和铸造,铸造性能也比纯铜好,硬度几乎提高一倍,适合制作工具和兵器。
铁的冶炼
到了春秋中后期,我国先民们在熟悉地掌握了块炼法炼铁后,又在世界上率先发明了以高温液体还原法冶炼生铁的技术,这在冶金史上是一个划时代的进步。
随着炼铁技术的进步,人们也逐渐懂得了炼钢。生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。依据文章内容回答下列问题。
(1)黑火药的主要成分是________。
(2)陶器与瓷器化学成分的主要区别是_________。
(3)生铁的碳含量______(填“高于”或“低于”)钢的碳含量。
(4)与纯金属相比,合金的优点可能是________。
【答案】 硝酸钾、木炭、硫(KNO3 、C、S) 陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高 高于 硬度大、熔点低
【解析】本题考查了根据短文黑火药、陶器与瓷器化学成分,铁合金的成分和性质,认真阅读短文是解题的关键。
(1)从题中提供的化学方程式可知,黑火药的主要成分是硝酸钾、木炭、硫(KNO3 、C、S);
(2)根据陶器与瓷器化学成分表可知,陶器与瓷器化学成分的主要区别是:陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高;
(3)生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。生铁的碳含量高于钢的碳含量;
(4)与纯金属相比,合金的优点可能是:硬度大、熔点低。
【题型】简答题
【结束】
21
【题目】工业上制取硝酸铵(NH4NO3)的流程图如下,请回答下列问题。
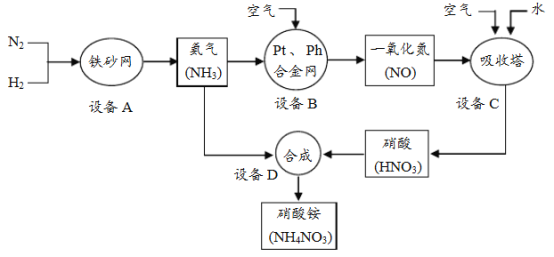
(1)设备A中,发生的反应属于基本反应类型中的________。
(2)设备B、C中,空气中的______一定参加了反应。
(3)设备C中,生产硝酸过程排出的废气中会含有一些氮的氧化物,可用如下两种
方法处理:
方法一、NaOH溶液吸收法:NO + NO2 + 2NaOH = 2NaNO2 + H2O
方法二、NH3还原法:8NH3 + 6NO2![]() 7N2 + 12H2O(NO也有类似的反应)
7N2 + 12H2O(NO也有类似的反应)
以上两种方法中,你认为哪种方法好并说明理由________。
(4)设备D中,用NH3和HNO3制备NH4NO3。NH4NO3中氮元素质量分数的计算式为________。
【题目】如下图所示,把足量的硫粉放入氧气中充分燃烧。
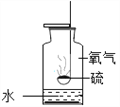
(1)硫在氧气中燃烧的反应方程式是______________________________。
(2)实验后,取少量集气瓶内的溶液于试管中,再往试管中滴加数滴的紫色
石蕊溶液,振荡。发现紫色石蕊溶液变成红色。
(提示:石蕊溶液是将石蕊加入水中溶解后得到的混合物)
【提出问题】是什么物质使紫色石蕊变红色呢?
【提出假设】假设1:水使紫色石蕊变红;
假设2:________________________使紫色石蕊变红;
假设3:二氧化硫与水反应的生成物使紫色石蕊变红。
【设计实验】
① 我们可判断假设____________不成立,因为石蕊溶液中含有这种物质,不能使紫色变红。
② 请设计一个实验方案验证另外两个假设是否成立,用文字描述实验步骤及填写预期实验现象和结论。(提供的试剂和用品有:干燥的紫色石蕊纸花若干朵、干燥的二氧化硫两瓶、水)
实验步骤 | 预期实验现象和结论 |
___________________________ | __________________________, 假设___________不成立。 |
____________________________ | __________________, 假设____________成立。 |