题目内容
【题目】下表列出了KNO3与NaCl在不同温度时的溶解度:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
KNO3的溶解度(g) | 13.3 | 20.9 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl的溶解度(g) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)KNO3和NaCl的溶解度相等的温度(t)范围是_____。
(2)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失)。方法一:①向混合物中加入适量水,加热溶解;②继续加热溶液至100℃并恒温蒸发浓缩;③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥。方法二:将混合物用饱和KNO3溶液反复浸洗,然后过滤。其中说法不正确的是_____。
A 方法一中除去KNO3中少量NaCl的主要方法是蒸发结晶
B 步骤③中,最多可得到KNO3晶体112.55g
C 方法二中浸洗前后,溶液中KNO3质量分数不变
D 步骤②中,为确保没有晶体析出,溶液中至少要保留50g水
(3)80℃时将一定质量的KNO3或NaCl溶液按图示进行操作,得到四杯溶液(蒸发过程为恒温蒸发):
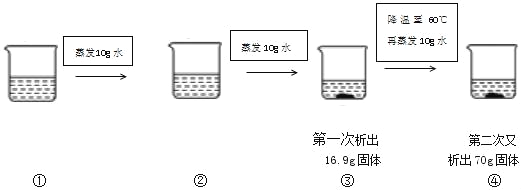
该溶液为_____(填KNO3或NaCl)溶液,烧杯①中的溶质质量为_____g。
【答案】20℃﹣40℃ A KNO3 185.9g
【解析】
(1)由KNO3与NaCl在不同温度时的溶解度可知,KNO3和NaCl的溶解度相等的温度(t)范围是20﹣40℃;
(2)A 由于硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响不大,方法一中除去KNO3中少量NaCl的主要方法是降温结晶,故A错误;
B 由于硝酸钾在100℃的溶解度是246g,根据溶解度概念可知,123g硝酸钾要溶解,至少需要水的质量是50g,在10℃硝酸钾的溶解度是20.9g,50g的水最多能溶解硝酸钾的质量为10、45g,步骤③中,最多可得到KNO3晶体是:123g﹣10.45g=112.55g;故B正确;
C 由饱和溶液的概念可知,饱和硝酸钾溶液,不能再溶解硝酸钾,但仍能溶解其他物质,用饱和KNO3溶液反复浸洗KNO3晶体,不再溶解KNO3晶体,溶液中KNO3质量分数不变,故C正确;
D 由上分析可知,步骤②中,为确保没有晶体析出,溶液中至少要保留50g水,故D正确。故选A;
(3)由题意可知,80℃时蒸发10g水析出16.9g固体,80℃时硝酸钾的溶解度是169g,恰好符合10g水溶解16.9g溶质,故该溶液为硝酸钾溶液;降温到60℃,这时硝酸钾的溶解度为110g,蒸发10g水会析出11g硝酸钾,由降低温度析出的硝酸钾晶体质量为:70g﹣11g=59g,由于80℃溶解度169g,60℃溶解度110g,降温析出169g﹣110g=59g,故③烧杯中水的质量为100g,溶质质量为169g,则烧杯①中溶质质量为169g+16.9g=185.9g。

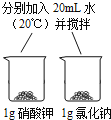
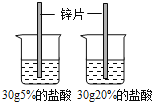
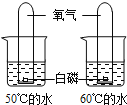
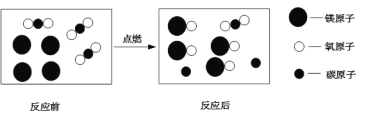
【题目】控制变量是种重要的实验方法.能达到实验目的方案是( )
A、探究反应物接触面积对反应速率的影响 | B、比较20℃时硝酸钾和氯化钠的溶解性(两者均易溶于水) | C、探究反应物浓度对反应速率的影响 | D、探究燃烧的温度是否须达到着火点(白磷着火点:40℃) |
|
|
|
|
A. AB. BC. CD. D