题目内容
【题目】已知相同条件下,气体的体积比即其分子个数比。一定条件下,下表所示的物质在密闭的容器内充分反应,测得反应前后各物质的质量如下表:
物质 | X | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
(1)相同条件下该反应生成的CO与CO2的质量比为________;体积比为________。
(2)若要使X充分燃烧,还需增加的氧气的质量为__________。
【答案】 7:11 1:1 1.6 g
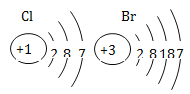
【解析】(1)根据质量守恒定律,3.2+11.2=7.2+4.4+a,得a=2.8,故由表可知, 该反应生成二氧化碳的质量为4.4g,生成一氧化碳的质量为2.8g,故该反应生成的CO与CO2的质量比为2.8: 4.4 =7:11;体积比等于分子个数比,一氧化碳与二氧化碳的分子个数比为![]() :
:![]() =1:1,故体积不为1:1;
=1:1,故体积不为1:1;
(2)若要使X充分燃烧需要氧气的质量就是使一氧化碳完全转化为二氧化碳需增加的氧气的质量,设2.8g的一氧化碳完全燃烧需要氧气的质量为x
2CO+ O2![]() 2CO2
2CO2
56 32
2.8g x
![]() =
=![]() ,解得x=1.6g;
,解得x=1.6g;

 举一反三单元同步过关卷系列答案
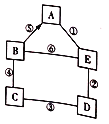
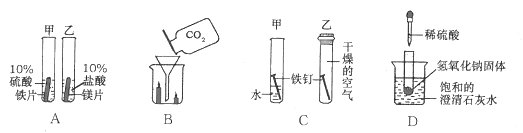
举一反三单元同步过关卷系列答案【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:

(1)试管A中的现象是 ,反应后试管B中一定有的阳离子是 (写离子符号)。
(2)试管C中反应的化学方程式为 。小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl 、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想 一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |