题目内容
【题目】金属在生产生活中有广泛应用。
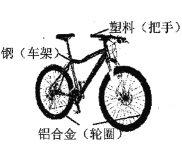
(1)共享单车作为代步工具,既轻便灵活,又环保。下图是一款自行车的图片,所标材料中,车架主要含有的金属元素是________,为防止车架生锈,可以采取的防锈措施是________,铝合金与纯铝相比,其硬度更_______(填“大”或“小”)。
(2)赤铁矿(主要成分Fe2O3)是炼铁的一种矿石,Fe2O3属于_______(填“单质”或“氧化物”)。我国是使用“水法冶铜”最早的国家,请写出铁和硫酸铜溶液反应的化学方程式________________________________。
(3)为了验证Fe、Cu、Ag三种金属的活动性顺序,下列选用的药品可行的是________(填序号)。
①Fe、CuSO4溶液、Ag ②FeSO4溶液、Cu、Ag
③FeSO4溶液、Cu、AgNO3溶液 ④FeSO4溶液、CuSO4溶液、Ag
(4)由两种元素组成的某合金6g与足量的稀硫酸充分反应后,生成0.2g氢气。下列说法不合理的是_________(填字母代号)。
A.合金中的元素可能是Fe和Cu B.所得溶液中的溶质可能是硫酸镁和硫酸
C.合金中的元素可能是Zn和Fe D.所得溶液中的溶质可能是硫酸铝和硫酸
E.合金中的元素可能是Zn和Ag F.所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸
【答案】 铁(或Fe) 刷漆 大 氧化物 Fe + CuSO4=Cu十FeSO4 ①③ E、F
【解析】(1)根据车架主要由钢构成分析解答;根据常用防止自行车架生锈的措施分析解答;根据合金的特点分析解答;(2)根据物质的分类分析解答;根据铁与硫酸铜溶液反应生成铜和硫酸亚铁解答;(3)根据“三取中”的思想分析解答;(4)根据反应的化学方程式计算解答。(1) 车架主要由钢构成,钢是铁的一种合金,故车架主要含有的金属元素是铁(或Fe);为防止车架生锈,可以采取的防锈措施是刷漆等;铝合金与纯铝相比,其硬度更大;(2) Fe2O3是由两种元素组成,且其中一种是氧元素,属于氧化物;铁与硫酸铜溶液反应生成铜和硫酸亚铁,反应的化学方程式为Fe + CuSO4=Cu+FeSO4;(3)首先将Fe、Cu、Ag三种金属按金属活动性顺序整理好,然后取中间位置的金属,另外两种取金属的可溶性盐溶液或取中间位置的金属的可溶性盐溶液,另外两种取金属,故选①③;(4)
Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=feSO4+H2↑
65 2 56 2
6.5g 0.2g 5.6g 0.2g
Mg+H2SO4=MgSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑
24 2 54 6
2.4g 0.2g 1.8g 0.2g
由以上可知,如果生成0.2g氢气时,单独消耗锌的质量是6.5g,单独消耗铁的质量是5.6g,单独消耗镁的质量是2.4g,单独消耗铝的质量是1.8g。A、铜不与稀硫酸反应,故合金中的元素可能是Fe和Cu,正确;B、若合金中的元素是2.4gMg和3.6gCu,则2.4g镁与足量硫酸反应生成硫酸镁,硫酸过量,故所得溶液中的溶质可能是硫酸镁和硫酸,正确;C、如果铁和锌按照一定的比例组合成6g时,生成的氢气可能是0.2g,正确;D、若合金中的元素是1.8gAl和4.2gCu,则1.8g铝与足量硫酸反应生成硫酸铝,硫酸过量,故所得溶液中的溶质可能是硫酸铝和硫酸,正确;E、银不与硫酸反应,如果生成0.2g氢气时,单独消耗锌的质量是6.5g,错误;E、如果生成0.2g氢气时,单独消耗镁的质量是2.4g,单独消耗铝的质量是1.8g,镁和铝不管以怎样的比例混合,生成氢气的质量都是大于0.2g的,错误。故选E、F。

【题目】已知相同条件下,气体的体积比即其分子个数比。一定条件下,下表所示的物质在密闭的容器内充分反应,测得反应前后各物质的质量如下表:
物质 | X | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
(1)相同条件下该反应生成的CO与CO2的质量比为________;体积比为________。
(2)若要使X充分燃烧,还需增加的氧气的质量为__________。