题目内容
 某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:NH4Cl+NaOH
某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:NH4Cl+NaOH
| ||
| 时间 | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量/g | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
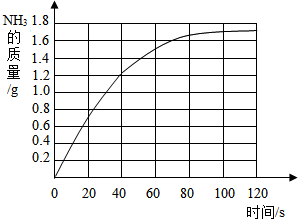
(1)请在图中画出产生气体的质量随反应时间变化关系曲线;
(2)样品中氯化铵的质量分数为
(3)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)利用数据表中测得的时间与增加的质量,找出对应的点并用平滑曲线连接;
(2)依据图表的数据特点得到生成的氨气的质量,根据反应的化学方程式,由生成氨气的质量计算出样品中氯化铵的质量,利用物质的质量分数的计算公式计算氯化铵的质量分数;
(3)根据反应的化学方程式,由生成氨气的质量计算反应生成氯化钠的质量,利用溶液中溶质的质质量分数的计算公式求算出硝酸钠的质量分数即可.
(2)依据图表的数据特点得到生成的氨气的质量,根据反应的化学方程式,由生成氨气的质量计算出样品中氯化铵的质量,利用物质的质量分数的计算公式计算氯化铵的质量分数;
(3)根据反应的化学方程式,由生成氨气的质量计算反应生成氯化钠的质量,利用溶液中溶质的质质量分数的计算公式求算出硝酸钠的质量分数即可.
解答:解:(1)根据测定数据表中的时间与质量数据确定一些点,然后把各点利用平滑曲线图连接;绘制曲线时要做到:曲线平滑、趋势正确、给出平台;
(2)根据测定数据表中的时间与质量数据可以知道硫酸当增重到1.7g时质量不再增加,所以生成氨气的质量是1.7g;
放出1.7g氨气消耗氯化铵的质量为x,生成氯化钠的质量为y,则:
NH4Cl+NaOH
NaCl+H2O+NH3↑
53.5 58.5 17
x y 1.7g
=
;
=
解得:x=5.35g,y=5.85g,
样品中氯化铵的质量分数=
×100%≈89.2%;
(3)所以反应后氯化钠溶液的质量=18g+6g+7.6g-1.7g-(6g-5.35g)=29.25g;则氯化钠溶液的质量分数为
×100%=20%.
故答案为:
(1)
 ;
;
(2)样品中氯化铵的质量分数为89.2%;
(3)反应后所得氯化钠溶液的溶质质量分数为20%.
(2)根据测定数据表中的时间与质量数据可以知道硫酸当增重到1.7g时质量不再增加,所以生成氨气的质量是1.7g;
放出1.7g氨气消耗氯化铵的质量为x,生成氯化钠的质量为y,则:
NH4Cl+NaOH
| ||
53.5 58.5 17
x y 1.7g
| 53.5 |
| x |
| 17 |
| 1.7g |
| 58.5 |
| y |
| 17 |
| 1.7g |
解得:x=5.35g,y=5.85g,
样品中氯化铵的质量分数=
| 5.35g |
| 6g |
(3)所以反应后氯化钠溶液的质量=18g+6g+7.6g-1.7g-(6g-5.35g)=29.25g;则氯化钠溶液的质量分数为
| 5.85g |
| 29.25g |
故答案为:
(1)
 ;
;(2)样品中氯化铵的质量分数为89.2%;
(3)反应后所得氯化钠溶液的溶质质量分数为20%.
点评:本题关键是计算出反应后的溶液的质量,根据质量守恒定律,反应后所得硝酸钠溶液的质量=样品质量+溶解所加水的质量+氢氧化钠浓溶液的质量-反应放出氨气的质量-样品中的杂质的质量.

练习册系列答案
相关题目
生活中处处有化学.以下过程只发生物理变化的是( )
| A、将氮肥硝酸铵和熟石灰混放会降低肥效 |
| B、用醋酸除去热水瓶内壁上的水垢 |
| C、被蚊子叮咬后涂抹肥皂水止痛 |
| D、冰箱内放入活性炭除去异味 |
 小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是
小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是