题目内容
【题目】实验是实现科学探究的重要途径。请回答以下有关化学实验的问题:
(1)仪器X的名称是 。
(2)过氧化钠(Na2O2)是一种淡黄色粉末,在通常情况下能分别与CO2、H2O、HCl发生反应,生成O2。为了验证CO2跟Na2O2反应生成的气体是O2,某化学兴趣小组同学设计了图中所示装置。
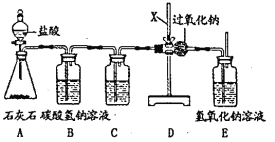
①用A装置制得的CO2中常混有H2O和HCl气体,设计B、C装置的目的是净化CO2气体。其中B装置的作用可用化学方程式表示为 .C装置瓶内的液体是 。
②E装置中氢氧化钠溶液的作用是吸收没有反应的CO2,发生反应的化学方程式为 .
③如何验证CO2和Na2O2反应严生的气体是O2?
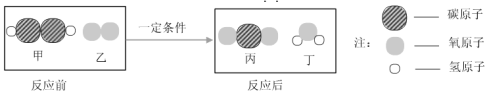
(3)硫酸铜常用作农业杀虫剂,如图是利用含铁废铜料生产硫酸铜的工艺。
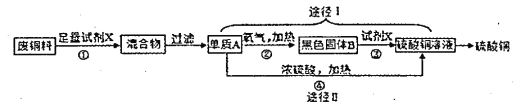
反应③的化学方程式为 ;
途径Ⅱ中,Cu+2H2SO4(浓)![]() CuSO2+SO2↑+2H2O.
CuSO2+SO2↑+2H2O.
从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点是 (写一条)。
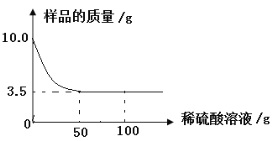
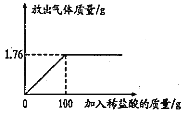
(4)某化学兴趣小组为测定石灰石样品中碳酸钙的质量分数,进行了如下实验探究:取5g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(杂质不溶于水,也不与稀盐酸反应),放出二氧化碳气体质量与加入稀盐酸的质量关系如图所示。计算:该石灰石样品中碳酸钙的质量分数。
【答案】(1)铁架台 (2)④NaHCO3+HCl=NaCl+H2O+CO2↑ 浓硫酸
②2NaOH+CO2=Na2CO3+H2O
③将带火星的木条靠近E装置中导气管的出口处,若木条复燃,则证明该气体是氧气。
(3)CuO+ H2SO4=CuSO4+H2O 生成等质量硫酸铜消耗的硫酸少(或无污染性气体产生等)
【解析】
试题分析:(2)①盐酸具有挥发性,会挥发出氯化氢气体,氯化氢溶于水形成盐酸碳酸氢钠溶液能与盐酸反应生成氯化钠、水和二氧化碳:NaHCO3+HCl=NaCl+H2O+CO2↑;由于水能与过氧化钠反应,故要将水除去,故C中的是浓硫酸,作用是起干燥作用;
②氢氧化钠与二氧化碳反应生成的碳酸钠和水:2NaOH+CO2=Na2CO3+H2O;
③氧气能使带火星的小木条复燃,故可将带火星的木条靠近E装置中导气管的出口处,若木条复燃,则证明该气体是氧气;
(3)废铜料中含有铁,要制的硫酸铜,要把铁除去,故X是稀硫酸,那么混合物中的是铜和硫酸亚铁,可通过过滤的方法除去硫酸亚铁得到铜;铜与氧气再加热的条件下反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水;途径I与途径Ⅱ相比不会产生二氧化硫,不会污染空气;
(4)利用化学方程式,根据反应的质量比即可计算出碳酸钙的质量。
解:设样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1. 76g
![]()
x=4g
CaCO3%=![]() ×100%=80%
×100%=80%
答:该石灰石样品中碳酸钙的质量分数为80%。

 阅读快车系列答案
阅读快车系列答案