题目内容
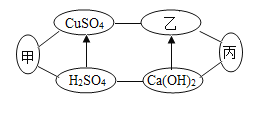
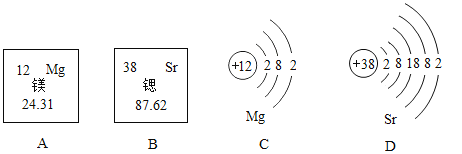
【题目】化学课上,同学们进行击鼓传花游戏,他们每个人代表一种化学物质,只要满足每关相应的要求,“花”就可以传递。已知两幅图中A同学均代表的是目前世界年产量最高的金属。请你利用所学知识帮助他们通关:

(1)第一关:要求相邻的物质之间可以发生反应。已知 C 是人体胃液中含有的一种酸,D、E 混合可以配制波尔多液。
①写出下列物质(或溶质)的化学式:B_______________、C_____________________。
②D 和 E 反应的化学方程式为__________________________。
(2)第二关:要求相邻的物质之间可以发生转化(如图,箭头指向生成物)。已知 B、C、D 均为氧化物,且B 为黑色,E 为非金属单质。
①写出下列物质的化学式:B_____________________、C________________。
②A 转化为 B 的化学方程式为_______________________。
③D 转化为 E 的化学方程式为_______________________________。
【答案】AgNO3 HCl Ca(OH)2 + CuSO4 = CaSO4 + Cu(OH)2 ↓ Fe3O4 CO2 3Fe + 2O2![]() Fe3O4 2H2O
Fe3O4 2H2O![]() 2H2 ↑+ O2 ↑
2H2 ↑+ O2 ↑
【解析】
(1)已知A同学代表的是目前世界年产量最高的金属,所以A为铁;已知C是人胃液中的一种成分,C为盐酸; B可以与A、 C反应,所以B为硝酸银;D、E混合可以配制波尔多液, D、E为氢氧化钙和硫酸铜,铁和硫酸铜反应生成铜和硫酸亚铁,氢氧化钙和硫酸铜反应生成氢氧化铜和硫酸钙,化学方程式为:Ca(OH)2 +CuSO4=Cu(OH)2↓+CaSO4,故填:AgNO3;HCl;Ca(OH)2 + CuSO4 = CaSO4 + Cu(OH)2 ↓。
(2)已知A同学代表的是目前世界年产量最高的金属,所以A为铁;B C均为氧化物,所以B为铁的氧化物,且B为黑色,B为四氧化三铁;C可以由四氧化三铁反应生成,所以C为二氧化碳或水中一种,由于C可以生成一种氧化物D,所以C为二氧化碳,E为非金属单质,同时可以冶炼铁,所以E为氢气,D为水,D电解可以生成E;
①由分析可得B为Fe3O4 C为CO2 故填:Fe3O4 ;CO2。
② 由分析可得A为Fe B为Fe3O4故A 转化为 B 的化学方程式为:3Fe + 2O2![]() Fe3O4。
Fe3O4。
③由分析可得D为水E为氢气故D 转化为 E 的化学方程式为:2H2O![]() 2H2 ↑+ O2 ↑。
2H2 ↑+ O2 ↑。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】阅读下面科普短文。
黄石被称为世界青铜文化的发祥地。青铜古称“吉金”,多为金黄色,主要是铜、锡、铅的合金。因其铜锈呈青绿色, 故名青铜。运用现代仪器分析青铜器及其锈蚀成分可以帮助我们对青铜器文物进行研究和保护。
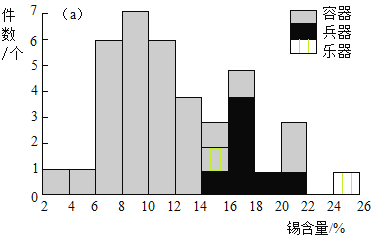
研究人员利用X射线能谱仪对我国西周晚期某墓地出土的青铜容器、兵器、乐器的成分进行了分析,其中锡含量的分布频次如图。
研究人员利用X射线衍射分析技术对“镇国之宝”后母戊鼎西南足部位的锈蚀样品进行分析,结果如下:
锈蚀成分 样品编号 | Cu2Cl(OH)3 | Cu2O | Cu2CO3(OH)2 | SnO2 | 其他 |
1 | 98% | 2% | 0 | 0 | 0 |
2 | 5% | 95% | 0 | 0 | 0 |
3 | 29% | 34% | 12% | 0 | 25% |
4 | 61% | 0 | 4% | 9% | 26% |
上述成分中,碱式氯化铜[Cu2Cl(OH)3]对青铜文物的危害极大,器物一旦沾染上这种物质,在环境湿度适宜的条件下,就会像患上瘟疫一样传染和蔓延,将会造成溃烂、穿孔,直至彻底瓦解。
依据文章内容回答下列问题。
(1)青铜器属于_________。
A 金属材料 B 合成材料
(2)由锡含量的分布频次图推断,某件青铜兵器的锡含量可能是_____
A 4% B 18%
(3)后母戊鼎西南足上的锈蚀成分中,Cu2O属于__________。
A 氧化物 B 盐
(4)碱式氯化铜[Cu2Cl(OH)3]的生成与环境中的氧气、水和_________密切相关。
A 氯化物 B 二氧化碳
(5)请你对保存珍贵的青铜器提出一条合理化建议____________。