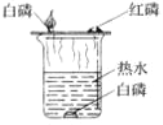
题目内容
【题目】兴趣小组对测定空气中氧气含量的实验进行了回顾和探究。
【实验回顾】
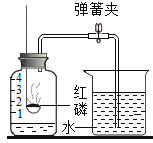
(1)实验室常用红磷燃烧的方法测定空气中氧气的含量,写出红磷燃烧的化学方程式_____________。
(2)兴趣小组用该方法测出的氧气含量常常低于1/5,可能的原因是①装置漏气;②______________,装置内氧气有剩余;……
(3)在老师的指导下,兴趣小组用正确的方法进行该实验,并用氧气浓度传感器测得反应后装置内氧气浓度为5.85%。
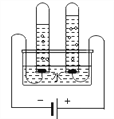
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量。于是进行了实验(装置如图)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
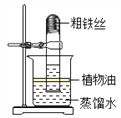
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点是________________。
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图),8分钟后测得的数据如下表:
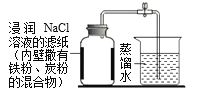
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131.0 mL | 90.0mL | 63.6mL |
请写出利用上述数据计算空气中氧气含量的计算式______________。
【结论与反思】通过上述实验探究,选择_________(填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿(化学方程式为2Cu+O2+H2O+CO2=Cu2(OH)2CO3)。若将实验探究1装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由___________。
【答案】 4P + 5O2点燃2P2O5 红磷量不足 更充分消耗氧气(合理即可) ![]() 铁粉、炭粉、氯化钠的混合物 空气中CO2含量只有0.03%,无法完全消耗氧气
铁粉、炭粉、氯化钠的混合物 空气中CO2含量只有0.03%,无法完全消耗氧气
【解析】红磷燃烧生成五氧化二磷:4P + 5O2![]() 2P2O5 ;
2P2O5 ;
红磷燃烧消耗氧气,导致集气瓶中的压强变小,水倒流入集气瓶中的体积即为氧气的体积。若装置的气密性不好或红磷不足或没有等集气瓶冷却就打开了止水夹均会导致进入集气瓶中的水偏小,从而导致测得的氧气的体积偏小;
由于可燃物要在含有一定浓度的氧气中才能燃烧,故用燃烧法不能将氧气完全消耗,而用铁丝生锈的方法测定则能更充分的消耗氧气;
该实验的原理是铁生锈消耗氧气,导致集气瓶中的压强变小,水倒流入集气瓶中的体积即为氧气的体积。由表格数据可知,倒流入集气瓶中蒸馏水的体积=90.0mL-63.6mL,该体积即为集气瓶中氧气的体积。集气瓶中空气的总体积为131.0 mL,故氧气的体积分数=![]() ;通过实验数据可知,利用铁粉、炭粉、氯化钠的混合物进行实验可较为快速地完成实验并减小实验误差;
;通过实验数据可知,利用铁粉、炭粉、氯化钠的混合物进行实验可较为快速地完成实验并减小实验误差;
【拓展延伸】由于铜要与空气中氧气、水、二氧化碳反应而锈蚀,而空气中二氧化碳的含量只有0.03%,当二氧化碳消耗完后,该反应就不能继续,那么不能完全消耗氧气,故不能用铜代替铁。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案