题目内容
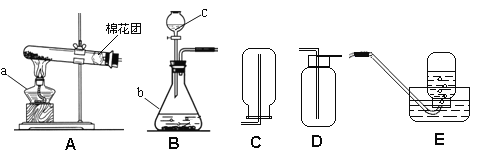
【题目】在实验室里可选用下列装置制取二氧化碳气体。

(1)制取气体前,首先要检查装置的_________________。
(2)制取二氧化碳的化学方程式为_________________。
(3)收集二氧化碳气体时,选用的装置序号是_________,理由是__________。
(4)检验二氧化碳气体是否收集满的方法是___________。
(5)利用上图中的发生装置,制取另一种气体的化学方程式为_____________。
【答案】气密性 CaCO3+2HCl=CaCl2+CO2![]() +H2O ④ 二氧化碳的密度比空气大 将燃着木条放在集气瓶口,看木条是否熄灭 2H2O2
+H2O ④ 二氧化碳的密度比空气大 将燃着木条放在集气瓶口,看木条是否熄灭 2H2O2![]() 2H2O+O2
2H2O+O2
【解析】
(1)制取气体的装置在使用前要先检查装置的气密性;
(2)大理石和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)二氧化碳密度比空气大,故用向上排空气法收集,选装置④;
(4)检验二氧化碳气体是否收集满的方法是:将燃着的木条放到集气瓶口,观察木条的燃烧状况,木条熄灭证明已满;
(5)该发生装置适用于固体和液体混合、不需加热制取气体的方法;实验室利用过氧化氢溶液和二氧化锰混合制取氧气、用锌和稀硫酸混合反应制取氢气,均不需加热,可用此制取;化学方程式为:2H2O2![]() 2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑)。
2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑)。

【题目】碳酸氢钠是化学实验中常见的药品,在工业上有很多制取方法。重庆一中兴趣小组的同学 们查询资料发现了一种“气相固碳法”:向氢氧化钠溶液中通入过量的CO2气体。
整理资料:Ⅰ、过量CO2通入NaOH溶液,发生两步反应:
①_________________________________(写出化学方程式);
②Na2CO3 +H2O + CO2=2NaHCO3
Ⅱ、碳酸钠和碳酸氢钠的溶解度表(部分)
温度/℃ | 0 | 15 | 20 | 30 |
Na2CO3 溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
NaHCO3 溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
15℃时,将10g氢氧化钠固体完全溶解溶于100g水中(如图1),而后匀速的通入二氧化碳气体,同时用pH计测定溶液的pH值变化(如图2)。

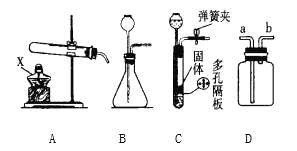
(1)图 1 所示实验中,产生 CO2 的装置应该选择:_____(填序号);
(2)为了确定M处溶液的溶质成分,取少量样品于试管中,进行如下实验:
步骤 | 加入试剂 | 实验现象 | 实验结论 |
① | 加入_______溶液 | 溶液变红 | NaOH和Na2CO3 |
② | 加入过量_______溶液 | ______ |
(3)实验中,t2后溶液的pH基本不变,则此时烧杯中观察到的现象是_____。