题目内容
【题目】下图是实验室制取气体的部分装置。
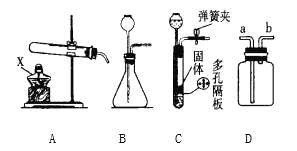
(1)仪器X的名称是______。
(2)写出A装置制取气体的化学方程式______,并写出如何检验该气体______?
(3)B和C装置均可制取气体,其中C装置的优点是什么______?
(4)若用D装置收集氢气,应该从______导管通入氢气;若用排水法收集氢气,也可以先在D的集气瓶中装满水,再从_____导管通人氢气。
(5)检验生成的气体是否是CO2,所涉及到的化学方程式为__________________。
(6)实验室要制取8.8g二氧化碳,至少需要含碳酸钙80%的石灰石多少克_____________?
【答案】酒精灯 2KMnO4 K2MnO4+MnO2+O2↑或2KClO3![]() 2KCl+3O2↑ 把带火星的木条伸到气体中,木条复燃,证明是氧气 可以控制反应的发生和停止 b b CO2+Ca(OH) 2=CaCO3↓+H2O 25g。
2KCl+3O2↑ 把带火星的木条伸到气体中,木条复燃,证明是氧气 可以控制反应的发生和停止 b b CO2+Ca(OH) 2=CaCO3↓+H2O 25g。
【解析】
(1)仪器X的名称是酒精灯,故填酒精灯。
(2)装置A是固体受热生成气体的发生装置,用该装置制取氧气的反应是加热高锰酸钾或继而氯酸钾与二氧化锰的混合物来制取氧气,故反应的化学方程式写为:2KMnO4 ![]() K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
检验氧气的方法是将带火星的木条伸到气体中,木条复燃,证明气体为氧气。
(3)C装置通过弹簧夹的开闭可以控制反应的发生与停止,故填可以控制反应的发生和停止。
(4)因为氢气的密度小于空气的密度,氢气应从短管进入瓶中,故填b;
氢气的密度小于水的密度,氢气应从短管进入瓶中,故填b。
(5)化学上常用澄清的石灰水来检验二氧化碳,因为二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,碳酸钙沉淀使石灰水变浑浊,故反应的化学方程式写为:CO2+Ca(OH) 2=CaCO3↓+H2O。
(6)解:设需要含碳酸钙80%的石灰石的质量为x

100:44=x×80%:8.8g
x=25g
答:需要含碳酸钙80%的石灰石的质量为25g。

【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。
(查阅资料)
①氧化铜(CuO)为黑色固体。铜不与稀硫酸反应。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O + H2SO4 ==== CuSO4 + Cu + H2O
(进行实验)
实验1:取质量比为1:11的木炭粉和氧化铜混合物1.3 g,进行实验。
序号 | 1-1 | 1-2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定质量的混合物,用1-2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2-1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2-2 | 1:10 | 混有很少量黑色物质 | |
2-3 | 1:11 | 混有极少量黑色物质 | |
2-4 | 1:12 | 无黑色物质 | |
2-5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)配平化学方程式:___C +__CuO![]() __Cu +__CO2↑
__Cu +__CO2↑
(2)实验1-2中,证明产生了CO2的现象是_______。
(3)实验1的目的是_______。
(4)实验2的结论是_______。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是_______。
(6)为检验2-4的红色固体中是否含Cu2O,所需试剂是_______。
【题目】俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于编制出了现代元素周期表的雏形表。下表为元素周期表的部分元素的部分信息,利用下表回答相关问题。
第一周期 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
第二周期 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
第三周期 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请画出16号元素的原子结构示意图__________,化学反应中该原子比较容易__________电子变成离子;
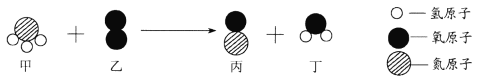
(2)![]() 表示的是________,其与17号元素形成的化合物是________
表示的是________,其与17号元素形成的化合物是________
(3)同一纵列元素原子的结构特点是________________
(4)上表中第二、三周期元素最外层电子数的变化规律是___________