题目内容
(2005?上海)30℃时Ca(OH)2在水中的溶解度为0.16g/100g水.在此温度下,实验小组为制备饱和的澄清石灰水,称取5.6g生石灰,放入1000g水中,充分搅拌后冷却至30℃,过滤得到的澄清石灰水中溶质的质量( )
【答案】分析:生石灰与水反应生成熟石灰,同时消耗水,熟石灰是溶质,先根据饱和溶液中公式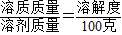 计算1000g水中实际溶解的溶质Ca(OH)2质量的最大值,再计算出5.6g生石灰可与水反应生成多少熟石灰,最后求出溶液中溶质的质量.
计算1000g水中实际溶解的溶质Ca(OH)2质量的最大值,再计算出5.6g生石灰可与水反应生成多少熟石灰,最后求出溶液中溶质的质量.
解答:解:设5.6g生石灰可生成熟石灰的质量为X
CaO+H2O=Ca(OH)2
56 74
5.6g X
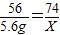 X=7.4g
X=7.4g
根据公式 ,1000g水中实际溶解的溶质质量最多为
,1000g水中实际溶解的溶质质量最多为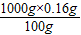 =1.6g,水中的氢氧化钙过量,且实际溶剂水的质量也小于1000g,所以过滤得到的澄清石灰水中溶质的质量小于1.6g.
=1.6g,水中的氢氧化钙过量,且实际溶剂水的质量也小于1000g,所以过滤得到的澄清石灰水中溶质的质量小于1.6g.
故选D.
点评:固体溶解度是初中化学的难重点,也是考查的重要热点,除考查对定义的理解,还涉及一些计算,正确理解溶解度的概念是解题的关键.
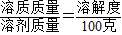 计算1000g水中实际溶解的溶质Ca(OH)2质量的最大值,再计算出5.6g生石灰可与水反应生成多少熟石灰,最后求出溶液中溶质的质量.
计算1000g水中实际溶解的溶质Ca(OH)2质量的最大值,再计算出5.6g生石灰可与水反应生成多少熟石灰,最后求出溶液中溶质的质量.解答:解:设5.6g生石灰可生成熟石灰的质量为X
CaO+H2O=Ca(OH)2
56 74
5.6g X
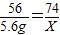 X=7.4g
X=7.4g 根据公式
 ,1000g水中实际溶解的溶质质量最多为
,1000g水中实际溶解的溶质质量最多为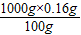 =1.6g,水中的氢氧化钙过量,且实际溶剂水的质量也小于1000g,所以过滤得到的澄清石灰水中溶质的质量小于1.6g.
=1.6g,水中的氢氧化钙过量,且实际溶剂水的质量也小于1000g,所以过滤得到的澄清石灰水中溶质的质量小于1.6g.故选D.
点评:固体溶解度是初中化学的难重点,也是考查的重要热点,除考查对定义的理解,还涉及一些计算,正确理解溶解度的概念是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ______;2mol二甲醚完全燃烧时需要______mol氧气.
______;2mol二甲醚完全燃烧时需要______mol氧气.